緩和に関するガイドラインは10種類以上ある
がん患者の治療抵抗性の苦痛と鎮静に関する基本的な考え方の手引き(2023年版)→鎮静
がん疼痛の薬物療法に関するガイドライン(2020年版)→疼痛コントロールに特化したガイドライン
非経口投与の薬
- 抗精神病薬
- ◎ロナセンテープ
- ◎シクレスト(舌下専用)
- ◎リスパダール(リスペリドン)
- ベンゾジアゼピン系
- ブコラム(ミダゾラム経口液)2.5㎎、5㎎、7.5㎎、10㎎ ※18歳以上には保険適応外となる恐れ
- ワイパックスの舌下投与(添付文書の投与法ではない)
- 睡眠薬
- ワコビタール座薬
- ブロマゼパム
- ダイアップ
- オピオイド
- アンペック
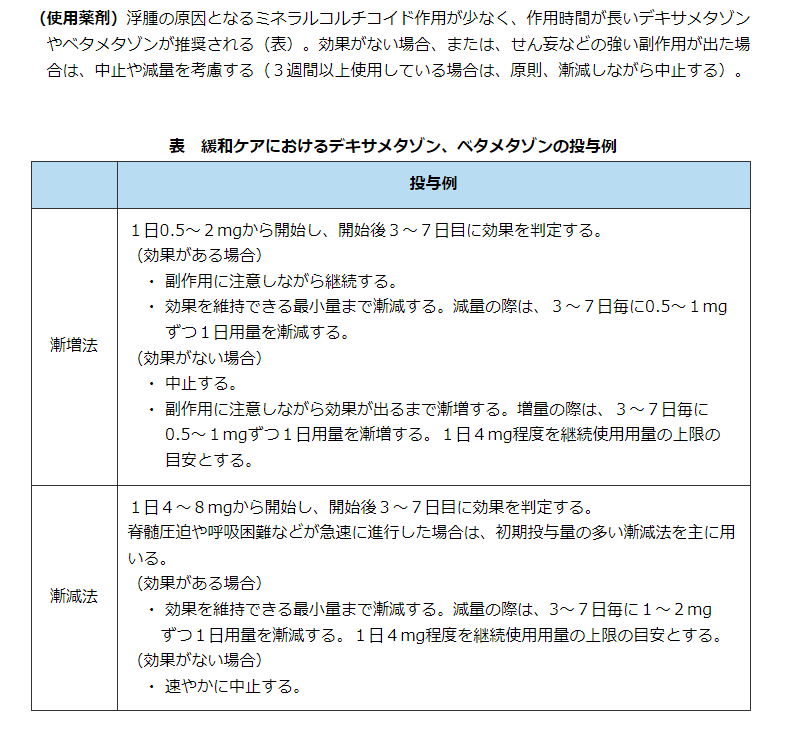
- ステロイド
- ベタメタゾン座薬(リンデロン)0.5㎎、1㎎
- NSAIDS
- ジクトルテープ
アセナピン舌下錠(シクレスト)→舌下専用
舌下が最も吸収が早い(Tmax=1時間)が口腔粘膜のどこからでも吸収される(バッカル投与でも可)
薬価が高い(先発品のみ)5mg=215円
MARTA阻害薬=D2遮断作用(陽性症状を抑える)+SDA作用(抗うつ作用)+抗ヒスタミン作用(催眠作用)を要する
MARTA=セロクエル、オランザピン、シクレストは同系統薬→シクレストは糖尿病でも使えるMARTA!
1日2回投与(半減期17時間)、1回量5~10mgと治療域狭い
夜間せん妄や不眠として使用する場合は、眠前に5mgを口腔内投与する
MARTAの1種だが糖尿病禁忌でない、抗コリン作用が弱い→安全性が高い
舌下投与し粘膜から吸収され、即効性が高いが、独特の刺激がある
http://www.kanwa.med.tohoku.ac.jp/study/pdf/index/2021/no03-02.pdf
ワイパックス(ロラゼパム)の舌下投与
薬を噛み砕いて舌下投与しても大丈夫
ワイパックスはほのかに甘みがあり舌下投与向き(ソラナックス/コンスタンは、とても苦い)
ワイパックスを発売しているファイザー社のデータでは、ワイパックスの舌下投与と経口投与では、血中濃度の変化がほとんど変わらないことが示されています
ロナセンテープ
ジクトルテープ
非オピオイド鎮痛薬の作用時間
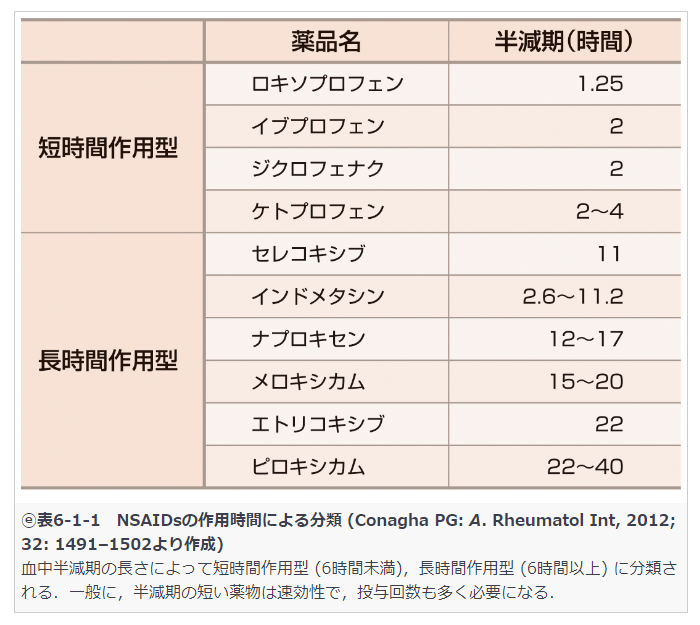
ロキソプロフェンNa 半減期1.25時間→屯用として使用した方がよい
アセトアミノフェン 半減期は2.36時間
セレコキシブ 半減期 約5〜9時間
ボルタレン 半減期 約1.3時間
ロピオン 5.8時間
痛みの種類とオピオイド感受性
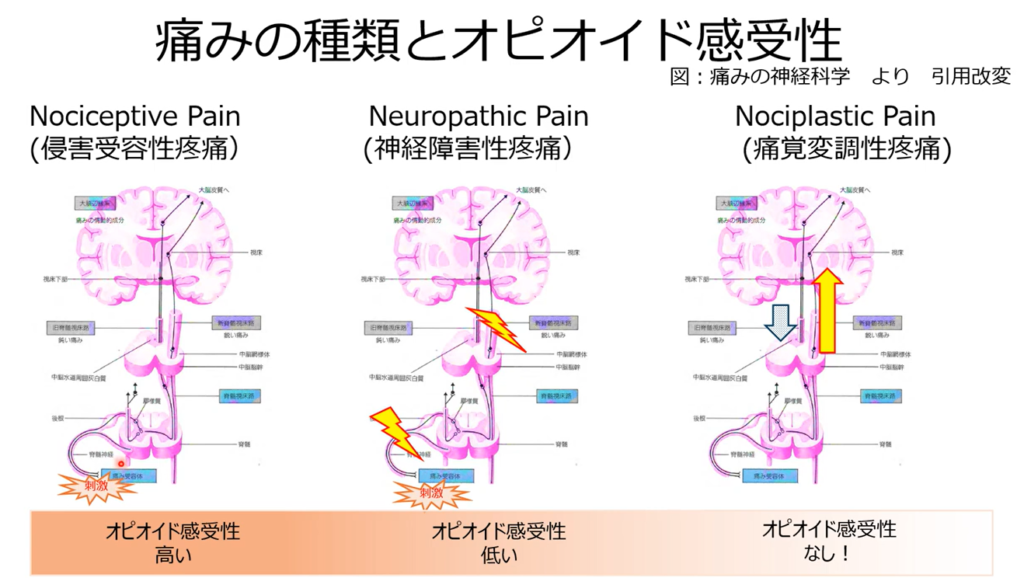
痛み診断が重要
・痛みの原因はがん?痛みの場所にがんがあるか?
・痛みの種類を考え、効果のある鎮痛剤を使用する

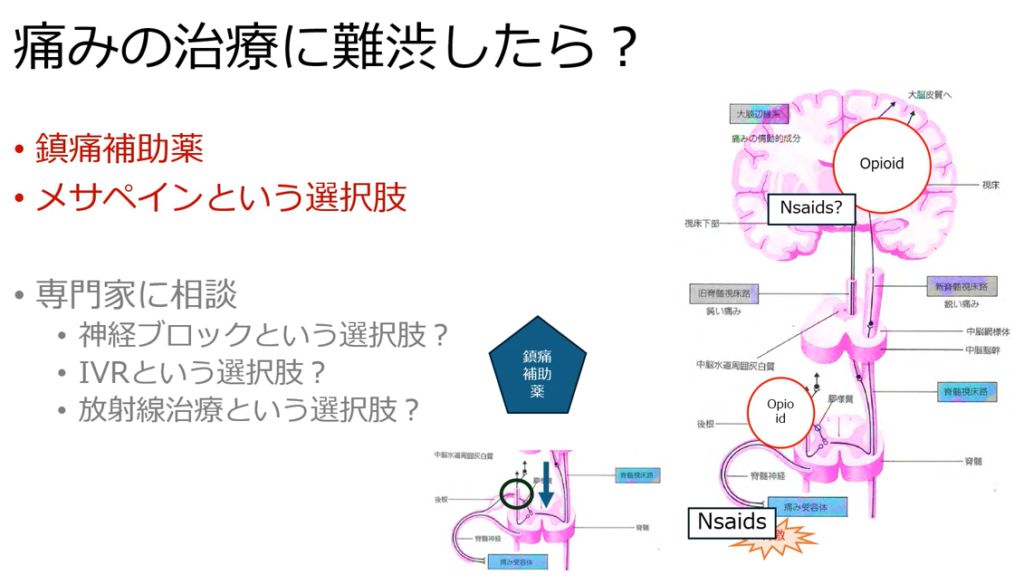
フェンタニルとの併用注意薬→CYP3A4に関連する薬剤

メサドン

制吐剤
鎮静
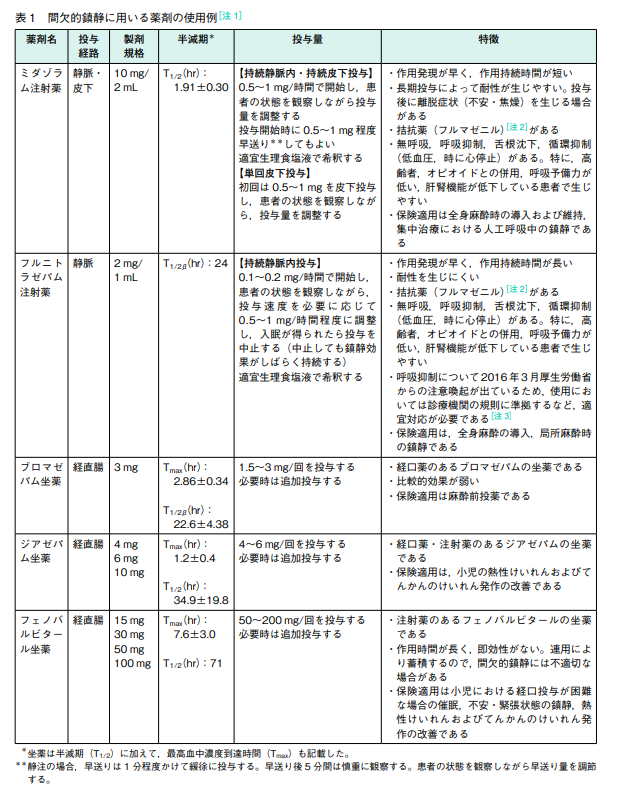
王道のミダゾラム
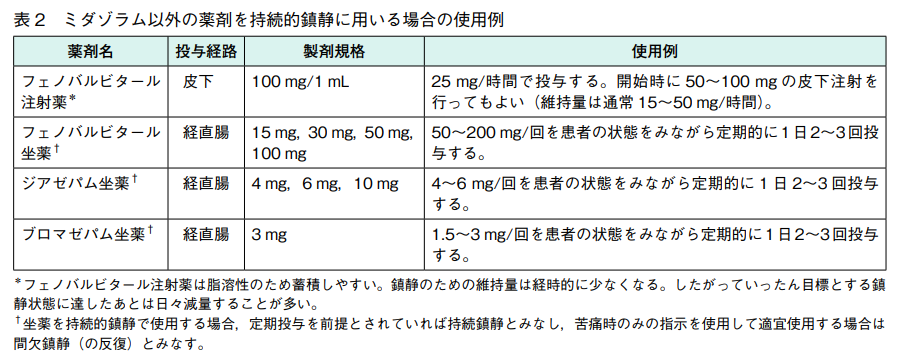
持続的鎮静に用いる薬剤の第一選択薬はミダゾラムである
ミダゾラムが有効でない場合には,フェノバルビタール注射薬などを使用する
皮下注・静注が使用できるならミダゾラム1択
1日20~30㎎(=2~3A)から開始
耐性が生じやすく1日ごとに投与量が増加することもある(できれば3週以内の投与にとどめる)
経口の最強!ヒルナミン・レボトミン(レボメプロマジン)
保険適応:統合失調症、うつ病、躁病のみ
規格:5㎎、25㎎、50㎎
鎮静作用は最強とされる、強すぎて調節性がない(真の最強はクロザピンだが処方できない)
処方例:5㎎2~4T分2
制吐剤として使用する場合は1日1回眠前5mg(最小規格が5mg) Tmax1~4時間、半減期15~30時間
統合失調症には1日25〜200mgを分割経口投与する
α遮断作用が強く低血圧の副作用あり
経口No.2 コントミン・ウィンタミン(クロルプロマジン)
保険適応:統合失調症以外にも吃逆、悪心・嘔吐、不安、抑うつの適応をもつ
規格:12.5㎎、25㎎、50㎎、100㎎
鎮静作用はヒルナミンに次ぐ2位で比較的調節しやすい
1日30〜100mgを分割経口投与、精神科領域では通常1日50〜450mgを分割経口投与
処方例:強い鎮静→25㎎2~4T分2、軽く鎮静→12.5㎎2T分2
制吐剤として使用する場合は12.5mg2錠分2 Tmax3.2時間、半減期11.7時間
最終手段のワコビタール座薬(フェノバルビタール)
即効性はない
保険適応:小児の催眠・不安・緊張状態の鎮静
熱性けいれん及びてんかんのけいれん発作の改善
規格:15㎎、30㎎、50㎎、100㎎(成人緩和領域では100㎎のみ)
半減期:50~120時間と長い
鎮静の有効血中濃度:フェノバルビタールとして 3.5~4.3μg/mL で効果をあらわす
抗痙攣作用は、フェノバルビタールとして 10~25μg/mL が必要
最高血漿中濃度到達時間は 7.6±3.0 時間
投与例:
200-0-200-0では日中過鎮静
100-0-300-0(フェントス3mg+ナルサス12mg併用)で夜間十分な鎮静が得られた
CYP代謝関連→フェントステープの薬効低下するおそれあり
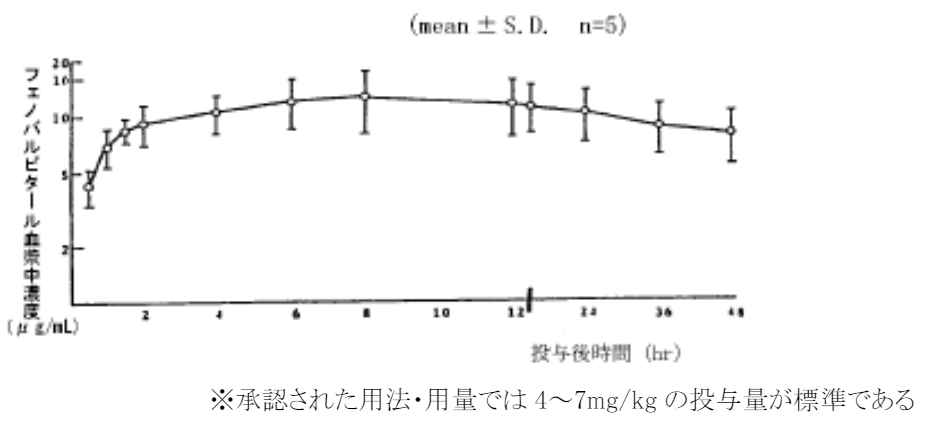
有用な催眠作用をあらわす一方、依存や耐性が生じやすく、血中濃度の上昇に伴い呼吸中枢や血管中枢などへの抑制作用が増強するため仮に過量投与となった場合に呼吸麻痺などの重篤な症状を引き起こす懸念が大きい。また薬の中断によってせん妄や痙攣発作などの退薬症候を生じることが考えられるため、睡眠改善目的での限定的となっていて、慢性的な不眠の改善に使われる睡眠薬としては本剤に比べ依存や耐性などの懸念がより少ないベンゾジアゼピン系睡眠薬や非ベンゾジアゼピン系睡眠薬などが主流となっている。
短時間作用型:ペントバルビタール(商品名:ラボナ)
中間作用型:アモバルビタール(商品名:イソミタール)
長時間作用型:フェノバルビタール(主な商品名:フェノバール)
バルビツレート酸系は最強の睡眠薬
がん患者の治療抵抗性の苦痛と鎮静に関する基本的な考え方の手引き(2023年版)
鎮静は,以下の 4 条件をすべて満たす場合には倫理的に妥当だと考えられる。





不眠
若い人→ベルソムラ+ゾルピデム+トラゾドン併用療法(精神科医処方)
緩和領域においてはベルソムラやデエビゴよりも確実な効果のある薬剤が推奨
トラゾドンは世界では睡眠薬としての認識(高用量で抗うつ効果)
痛くて眠れない→ゾルピデム+プレガバリン50㎎眠前
嘔気で眠れない→ゾルピデム+ミルタザピン15㎎0.5T眠前 など
- 超短時間型
- ゾルピデム(マイスリー)半減期2.3時間
- エスゾピクロン(ルネスタ)アモバンの改良型
- 短時間型
- ブロチゾラムOD(レンドルミンOD)半減期7時間
- 中時間型
- フルニトラゼパム(サイレース)半減期7~24時間
トラゾドン(デジレル)
せん妄予防効果も期待できる
不眠症に対して使用する場合は25~50㎎
作用時間は短い(6時間)→より長いのがミアンセリン(テトラミド)で18時間
超短時間型や短時間型に併用するとよい
α遮断作用があるため起立性低血圧になりやすい
不穏
日中の不穏
鎮静作用が弱い薬が推奨
ロナセンテープ
リスペリドン
バルプロ酸
抑うつ
抑うつ
+せん妄・不眠・不安→トレドミン
+嘔気・不眠→リフレックス
+神経障害性疼痛→サインバルタ
◎レクサプロ(エスシタロプラム:SSRI)
◎リフレックス(ミルタザピン:NaSSA)
サインバルタ(デュロキセチン:SNRI)
鎮痛補助剤としての効果も期待するなら選択肢
薬物相互作用
SSRIとトラマドール、タペンタドールの併用はセロトニン症候群のリスクを高める
レクサプロ(エスシタロプラム:SSRI)
効果発現が早い、抗うつ剤の第一選択(忍容性と有効性がともに高い)
レクサプロ10mg分1スタート(投与初期に制吐剤併用も検討)
投与初期に嘔気が出やすいので緩和では使いづらいかも
リフレックス(ミルタザピン:NaSSA)
1日1回、眠前投与
Naとセロトニンを増やし、抗ヒスタミン作用で眠くなる→せん妄、激越の副作用あり(頻度不明)
制吐作用があるので緩和領域では使用しやすい、食欲増進効果も期待できる
眠気の副作用は、2~3日をピークに、1~2週間で慣れていくことが多い
鎮静系抗うつ薬として理解(リフレックス、テトラミドは構造式が酷似し効果も似ている)
MANGAstudyではもっとも有効性が高い抗うつ剤という評価
カリフォルニアロケット療法(SNRIとの併用療法)
骨転移
日本癌治療学会・日本緩和医療学会【癌疼痛の薬物療法に関するガイドライン2014】
投与後4~12 週の鎮痛効果を期待する場合にはBMA投与を行う。
ビスホスホネートとデノスマブで効果に有意差なし
→費用対効果や投与方法の簡便さを考慮して選択する
腎不全、1割負担者→デノスマブ(ランマーク45000円)
3割負担者→ビスホスホネート(ゾレドロン酸6900円)
NCCN のガイドライン(2012)
NSAIDs は脊髄圧迫のない骨転移による痛みに対して推奨されており,BMA,コルチコステロイドは多発性骨転移による痛みに対して推奨されている。
ESMO のガイドライン(2012)
ビスホスホネートは通常の鎮痛治療に代替するものではないが,骨転移による痛みに対して有効な根拠があるとしている。
骨転移による痛みのあるがん患者において,ビスホスホネート,デノスマブなどのbone-modifying agents(BMA)は投与後4~12 週では中等度の鎮痛効果があるが,投与後4 週以内に鎮痛効果があるという根拠はない。また,これらは現在痛みのある患者に対しての鎮痛効果の目的で用いられたものではない。
骨転移による痛みに対して,予測される生命予後を検討したうえで鎮痛を目的としてBMA を投与することを推奨する。すなわち,投与後4~12 週の鎮痛効果を期待する場合には投与を行う。一方,投与後4 週以内の鎮痛効果に関するエビデンスは確立されていないため,「現在の痛み」を緩和するためにはBMA 以外の疼痛治療を十分に行うことが必要である。
がん疼痛の薬物療法に関するガイドライン(2020年版)
日本緩和医療学会



1 )ビスホスホネート
本臨床疑問に関するビスホスホネートについての臨床研究としては,無作為化比較試験30 件を含む系統的レビューがある(Petcu ら1))。
(1)投与後4~12 週の効果
ビスホスホネート投与後4 週から12 週での有効率については8 件で検討されている。有効の定義は,それぞれの研究で,①6 点のスコア方式において,2 回以上連続して1 点以上減少あるいは1 回の測定で2 点以上減少,② 0~5 段階のスコア方式において,2 回以上連続してスコアが20%以上減少,③無痛になった場合などと異なっている。これらを原著の定義のまま「有効」とした場合,4 週において有効であった患者数は,ビスホスホネート治療群214 例中40 例(18%),対照群194 例中18 例(9%)で,NNT 11(95%信頼区間:6~36)であった。一方,12 週においては,ビスホスホネート治療群317 例中103 例(32%),対照群317 例中55 例(17%)で,NNT は7(95%信頼区間:5~12)であった。副作用は,治療群の16%,対照群の15%に悪心・嘔吐を認めたが有意差はなかった。副作用による治療中止は,治療群の6%,対照群の0.6%に生じ,治療中止を要するような有害事象に関するNNH は16(95%信頼区間:12~27)であった。
(2)投与後4 週以内の効果
投与後4 週以内の鎮痛効果に関する臨床研究としては,無作為化比較試験,前後比較研究はなく,パミドロン酸投与後6 日目に鎮痛効果を得たという症例報告がある程度である(Eugen ら)。
2 )デノスマブ
本臨床疑問に関するデノスマブについての臨床研究としては,プラセボを対照とした無作為化比較試験はないが,ビスホスホネートであるゾレドロン酸を対照とした3 件の無作為化比較試験を含む系統的レビューがある。
Peddi ら2)による系統的レビューでは,乳がんと前立腺がんおよびその他のがん種を対象とした3 件の無作為化比較試験結果について検討している(Stopeck ら3),Fizazi ら4),Henry ら5))。
3 件の臨床研究では,疼痛評価を0(支障なし)から10(最大の支障)段階で評価するBrief Pain Inventory(BPI)を用いて,4 段階以上の悪化を疼痛増悪,2 段階以上の減少を疼痛軽減と定義している。その結果,デノスマブを投与した患者での疼痛増悪までの期間(5.5~9.7 カ月)は,ゾレドロン酸を投与した患者での疼痛増悪までの期間(4.7~5.7 カ月)と比較して疼痛増悪までの期間を延長し,ハザード比は0.8(95%信頼区間:0.8~0.9)であった。一方,疼痛軽減までの中央値については,両群間で有意差を認めなかった。
**
以上より,骨転移による痛みのあるがん患者において,ビスホスホネート,デノスマブなどのbone-modifying agents(BMA)は投与後4~12 週では中等度の鎮痛効果があるが,投与後4 週以内に鎮痛効果があるという根拠はない。また,これらは現在痛みのある患者に対しての鎮痛効果の目的で用いられたものではない。
したがって,本ガイドラインでは,骨転移による痛みに対して,予測される生命予後を検討したうえで鎮痛を目的としてBMA を投与することを推奨する。すなわち,投与後4~12 週の鎮痛効果を期待する場合には投与を行う。一方,投与後4 週以内の鎮痛効果に関するエビデンスは確立されていないため,「現在の痛み」を緩和するためにはBMA 以外の疼痛治療を十分に行うことが必要である。
鎮痛補助薬 一覧(緩和治療ガイドライン2020より)

がん終末期の緩和治療(総論)
癌緩和ケアガイドブック(日本医師会)H28年作成
終末期がん患者の輸液療法に関するガイドライン2013年版(日本緩和医療学会)
がん疼痛の薬物療法に関するガイドライン(日本緩和医療学会)2020年版
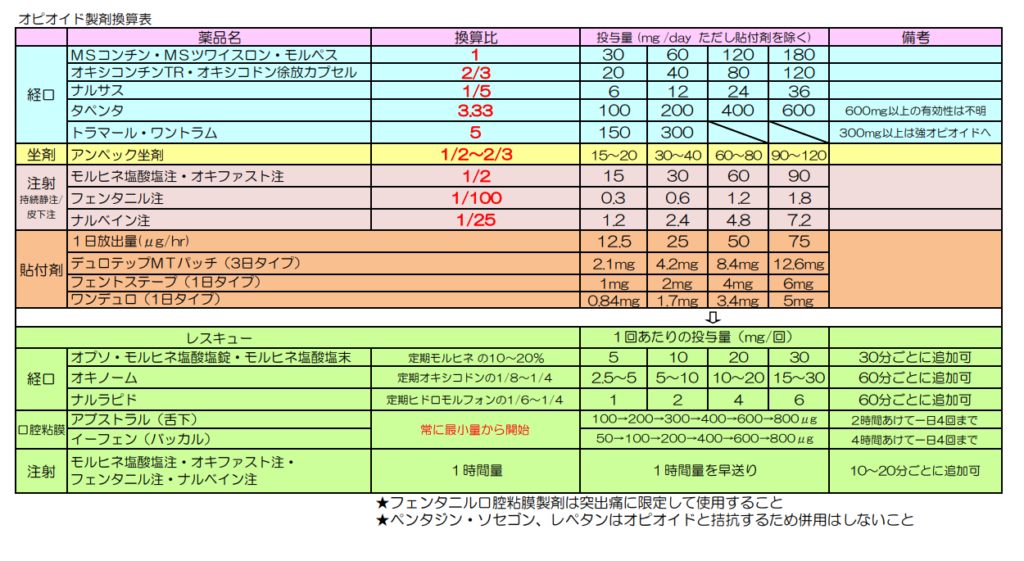
ナルベイン、モルヒネ塩酸塩(注射剤)には濃度の異なる2規格があるためオーダー時注意
院内規格は1種類に統一する
経口摂取困難時の緩和→フェントス+ロナセン(せん妄治療・制吐)+ジクトルテープ
ロナセンの鎮静作用は強くない→ダイアップ坐薬など
モルヒネ投与時の注意
モルヒネ硫酸塩(MSコンチン)とモルヒネ塩酸塩は別の薬剤!

がん終末期の緩和治療(各論)
がん悪液質とエドルミズ(アナモレリン塩酸塩)
進行がん患者の80%に見られる悪液質になると、骨格筋と脂肪組織が委縮し、食欲も失われるほか、炎症性マーカーも上昇する
従来の栄養サポートで改善させることが非常に困難

エドルミズの投与方法
適応:非小細胞肺癌、胃癌、膵癌、大腸癌
成人にはアナモレリン塩酸塩として 100mg を 1 日 1 回、早朝空腹時に経口投与
食事の影響を避けるため本剤は空腹時に服用(エドルミズの吸収が低下する)し、本剤服用後1時間は食事をしないこと
本剤投与により体重増加又は食欲改善が認められない場合、投与開始3週間後を目途に原則中止する
12週間を超える本剤の投与経験はない
エドルミズの禁忌

糖尿病は禁忌ではないが血糖を上昇させることがある
癌緩和ケアのステロイド
デカドロン0.5mg4T(=4mg0.5Tでも◎)分1あさ
呼吸困難感・呼吸苦
がん患者において呼吸困難の発生する頻度は 46~59%
もちろん◎モルヒネ→呼吸困難にも咳嗽にも有効
呼吸困難→ベンゾジアゼピンやステロイド(長時間型のベタメタゾンやデキサメタゾン)
咳嗽→◎メジコン、△プレガバリン・ガバペンチン、△リドカイン吸入(エビデンス乏しい)
麦門冬湯、
がん患者の呼吸器症状の緩和に関するガイドライン(2016年版)
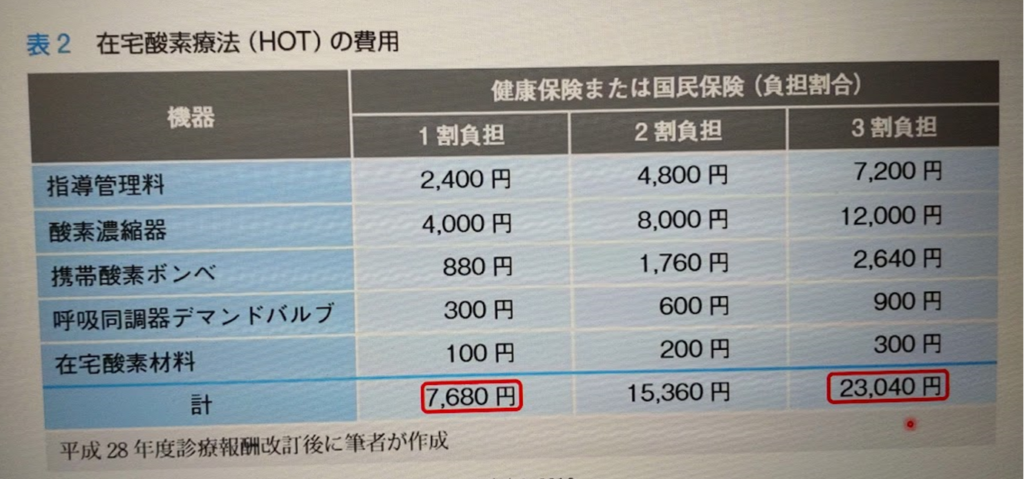
低酸素血症がある場合のみ酸素投与が有効
モルヒネが最も使用されるが、腎不全時にはヒドロモルフォンが使用しやすい
エンドステージの場合には、少量モルヒネを投与してもよい(→呼吸苦に使用するモルヒネは10-20㎎程度で効果頭打ちとなるので、鎮痛効果を求める場合にはモルヒネ高用量投与よりも呼吸苦対策に少量モルヒネ+鎮痛対策のヒドロモルフォンの併用という方法もある)
在宅緩和では経口剤が困難な場合はモルヒネ座薬(アンペック)も使いやすい
非薬物療法として、送風機によるかぜが効果的な場合もある
オピオイドによる嘔気やせん妄が強い場合には、モルヒネ塩酸塩(またはヒドロモルフォン塩酸塩注射液)とハロペリドール2.5~5㎎の混合液を持続皮下注してもよい(皮下硬結が出る場合(約4割に出現)にはハロペリドール中止する)
ただし、タイトレーション中(用量調整中)に混注するとフラッシュ等でハロペリドール過剰投与となる恐れがあるため、混注量は少量から開始する方がよい
※気道分泌物が多い場合には、①点滴をやめる、➁抗コリン薬をモルヒネ持続皮下注に混ぜる(ハイスコ)
→https://www.seirei.or.jp/mikatahara/doc_kanwa/contents6/33.html#anchor541

死前喘鳴の緩和治療のoverview

https://www.seirei.or.jp/mikatahara/doc_kanwa/contents6/33.html#anchor541
再膨張性肺水腫のメカニズムは,気胸が発症すると肺換気血流比の是正が起こり大きく虚脱した肺には血流の分布が少なくなる
そうした肺を勢いよく膨張させると一気に血流の再分布が起こり,膨 張させた肺の血流が多くなる
それに加え虚脱していた肺内の微小血管が肺の膨張とともに引き伸ばされることによりダメージを受ける
肺虚脱時間が長く虚脱率が大きいほど発生しやすい
肺毛細血管から肺胞へ血液成分の漏出がおこり多量の泡沫状血性痰を認め,喘鳴を聴取する
肺水腫が高度な場合,呼吸困難や低酸素血症に陥り,また,血漿漏出による低容量性ショックをきたし死亡する場合もある
人工呼吸器による適切な呼吸管理が必要であり,片側性肺水腫がみられる場合は左右分離肺換気を考慮する
咳嗽
鎮咳作用はモルヒネ>コデイン(らしい)
鎮咳効果については,コデイン自体が延髄の咳中枢を抑制すると想定されており,鎮咳薬として使用される理由となっている。
しかしながら,コデインの鎮咳作用は,十分量投与されたモルヒネと比較すると弱いと考えられている。 ジヒドロコデインは,コデインの誘導体であり,鎮咳効果はコデインに比べ強い (力価はコデインの 2 倍)。
疼痛
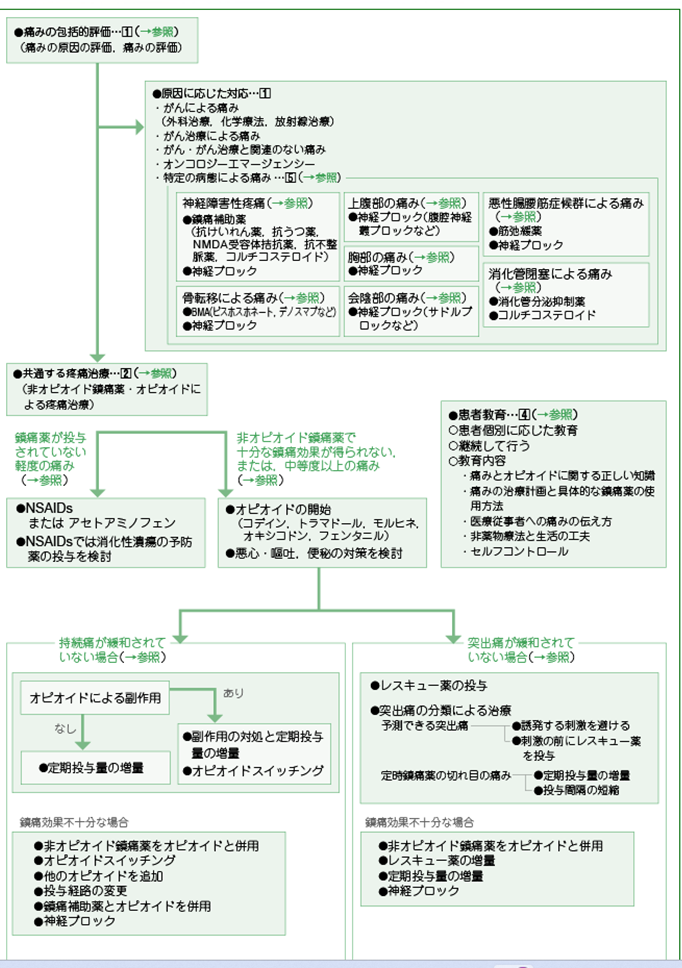
WHO方式三段階鎮痛法
「WHOがん性疼痛に関するガイドライン」の2018年改訂によりWHO方式三段階除痛(鎮痛)ラダーは本文から削除されたが、現行のガイドラインにおいても「三段階除痛ラダーは疼痛マネジメントにおける一つの目安である」とされANNEX(付録)に残っている。

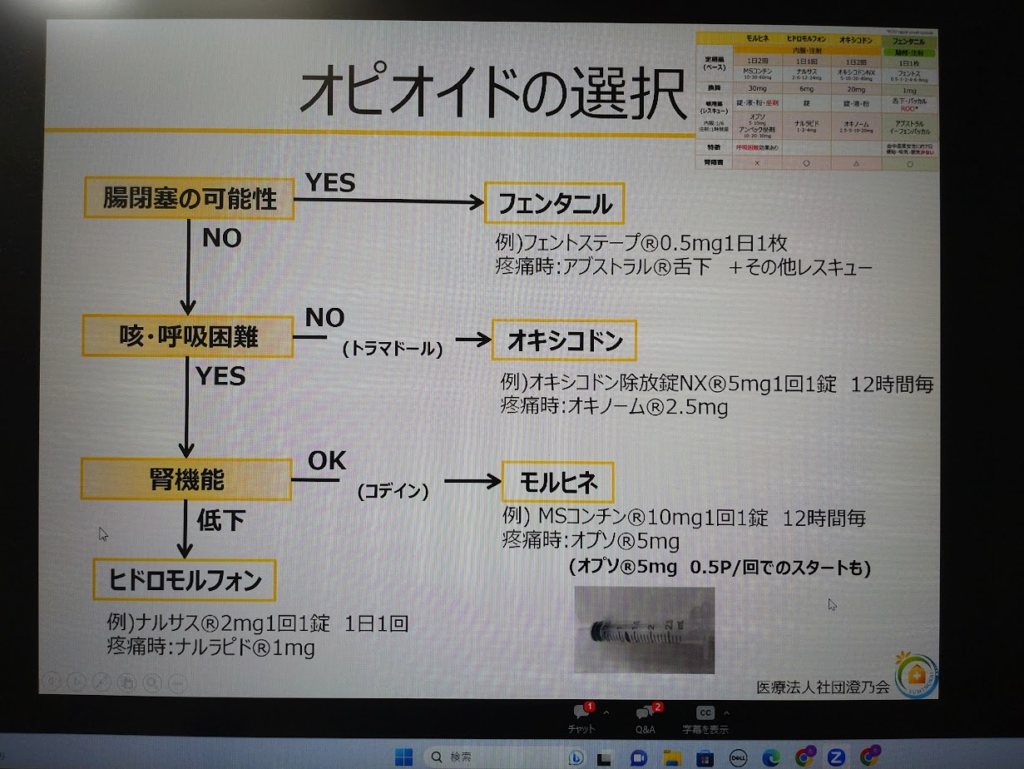
オピオイド選択のアルゴリズム
単純に痛みをとりたい→オキシコドン(錠剤)+オキノーム(散剤) ※剤形が異なるメリットあり
ただし、後発品はオキシコンチン徐放錠、オキシコンチン即放錠で見分けが困難
呼吸苦をとるならモルヒネ(MSコンチン、オプソ、アンペック、注射)またはナルサス

- 癌緩和治療の置き薬(初回訪問時に自宅に置いておく、Y先生)
- アンペック5㎎…5回分
- ボルタレン座薬25㎎…5回分
- ナウゼリン座薬30㎎…5回分
- ノバミン5㎎2T分2は初回から併用
- オキノーム2.5㎎?…5回分
- 初回から便秘薬も出した方がよいだろう
- レスキュー薬の使用注意事項(Y先生)
- オキノームよりアンペック10㎎の方がよく効く→用量の違いによる
- アンペックの規格は10㎎、20㎎、30㎎だが、10㎎を使用する→20㎎なら2個、5㎎なら半分に切って使用
- オピオイドレスキューの基本原則
- 経口投与
- 1 回量はベースであるオピオイドの 1 日投与量の 10~20%→4~6回使用で1日量となることが目安
- 投与間隔は 1時間あけること
- 経静脈・皮下投与
- 1時間量、30分毎に追加
- 経口投与

https://www.ncc.go.jp/jp/ncch/clinic/palliative_care/201901opioid.pdf
各種オピオイド
- オキノームについて
- オキシコドンは肝代謝のため腎不全にも減量不要で慎重投与可能
- 服用後効果が出るまでに 15~30 分時間がかかる
- 60 分しても効果の無いときには再度オキノーム散を内服
- 1 日に服用できる回数の制限なし→代謝産物の蓄積がないため
- 服用しても症状が緩和されないとき、1 日 6 回以上服用しても症状が続くときはベースアップ
- モルヒネ全般について
- モルヒネの分類:
硫酸塩と塩酸塩の違いは合成方法であり,鎮痛効果や副作用,薬物動態に差はない(併用可)
塩酸塩:徐放製剤に利用→オプソ、アンペック、注射製剤
硫酸塩:即効性製剤に利用→MSコンチン、モルぺス細粒 - モルヒネ塩酸塩注には1%製剤(1A=10㎎/1mL、50㎎/5mLの2規格)と4%製剤(1A=200㎎=5mL)がある
- 腎不全下ではモルヒネは有害な代謝産物(Morphine-3-gluclonides)が蓄積するので、せん妄やミオクローヌス(痙攀)などを起こしやすくなるため、eGFR30以下の場合使用は原則禁忌
- モルヒネの代謝産物M6Gには鎮静・鎮痛効果があるため、腎不全者は作用が増強される
- アンペック:規格は10㎎、20㎎、30㎎
- 服用後効果が出るまでに 30 分程度時間がかかる
- 1時間しても効果がない場合はもう一度使用可
- 作用時間は 6~8 時間程度
- アンペック10㎎=オプソ15㎎=オキノーム10㎎相当なのでかなり高用量!
- オプソ:規格は5㎎、10㎎
- モルペス細粒:
錠剤やカプセルを飲み込めない患者に有用
また粒子径は小さく,8 Fr以上の経管チューブであれば経管投与が可能
- モルヒネの分類:
- ヒドロモルフォンについて
- ヒドロモルフォンはモルヒネと構造が似ていることから、呼吸困難や咳嗽による苦痛が緩和できる可能性がある
- 欧州臨床腫瘍学会のガイドラインでは、がんによる呼吸困難の治療薬としてモルヒネ、ヒドロモルフォンを挙げている
- 持続皮下注で用いた場合、モルヒネと比較して皮下硬結が生じにくいという報告がある
→モルヒネ皮下注では1%製剤で10.6%,4%製剤で23.5%と報告されている - ヒドロモルフォンの注射薬:ナルベイン→2種類の濃度があるため注意!
- 成人にはヒドロモルフォンとして1日0.5〜25mgを持続静脈内又は持続皮下投与
- オピオイド投与がない場合:
1日0.5〜1.0mgから開始し、鎮痛効果及び副作用の発現状況を観察しながら用量調節を行う - オピオイドローテーションの場合:
前治療薬の投与量等を考慮し、投与量を決めること。本剤の1日用量は、ヒドロモルフォンとして、モルヒネ注射剤1日用量の1/8量を目安とすること。
ヒドロモルフォン経口剤から本剤に変更する場合には、ヒドロモルフォン経口剤1日用量の1/5量を本剤の1日用量の目安とすること。
- フェンタニル
- 高度な腎機能障害を有する患者では第一選択
- フェンタニルの1日1回貼付製剤は,定常状態に達するまでに約4~5日間を必要とするため,短期間での増量による過量投与に注意する
- 経粘膜性フェンタニル:ROO
- モルヒネやオキシコドンの速放性製剤(short-acting opioid;SAO)に対して、口腔粘膜や鼻粘膜を介して迅速に吸収されることから、即効性オピオイド(rapid-onset opioid;ROO)と呼ばれ、効果発現時間は 10~15 分と速く、持続時間は 1~2 時間
- 使用条件:
①持続痛がしっかりとコントロールされていることを確認する
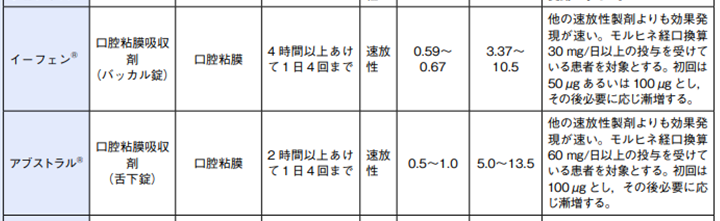
➁ベースの経口モルヒネ換算量(バッカル錠は30mg/日以上、舌下錠は60mg/日以上)の目安がある - 使用方法・制限:
- 投与30分後に痛みが残存する場合は同一用量以下を1回のみ追加できる
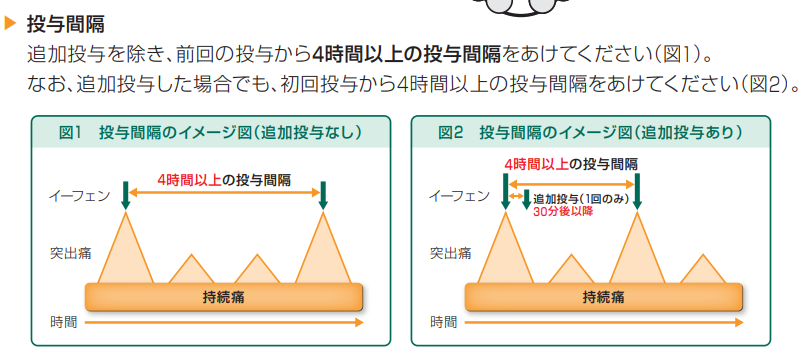
- 両剤ともに 1 日 4 回まで使用回数制限がある
- 投与間隔はイーフェン®は 4 時間以上、アブストラル®は 2 時間以上→イーフェンの方が安全域が広い
- 飲み込んでしまった場合の吸収率は両剤ともおよそ30%程度とされている
- 後発品はまだない(2023年12月)
- 定時投与薬によるコントロールが良好であることが条件
- 超即効性の薬理作用(すぐ効いて作用時間も短い)を期待する場合に選択→鋭い突出痛に有効!
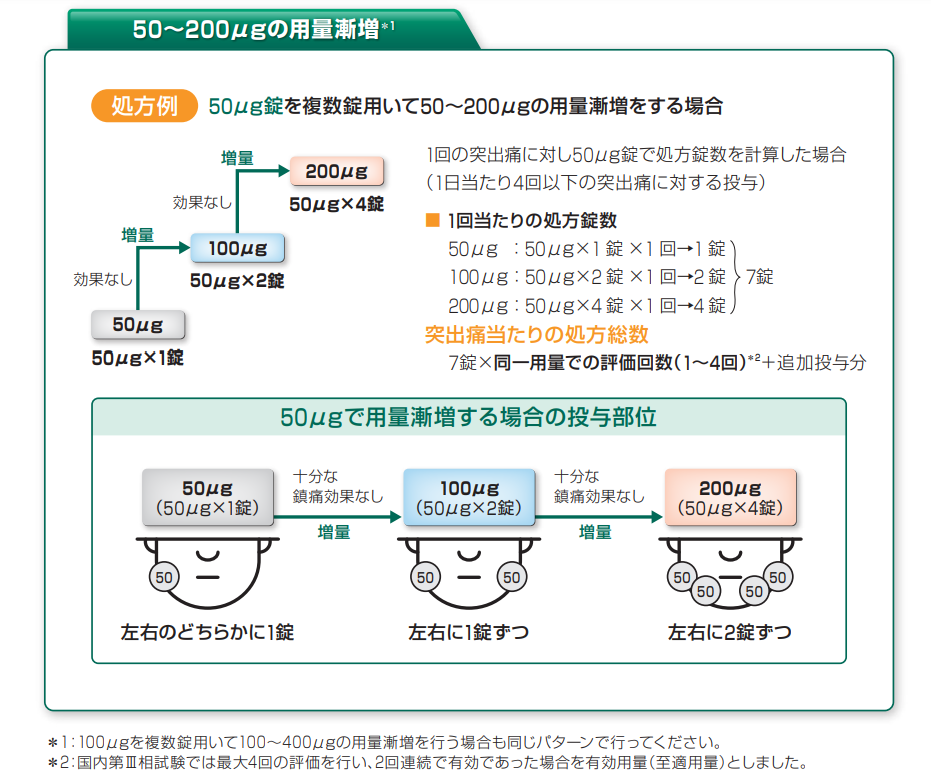
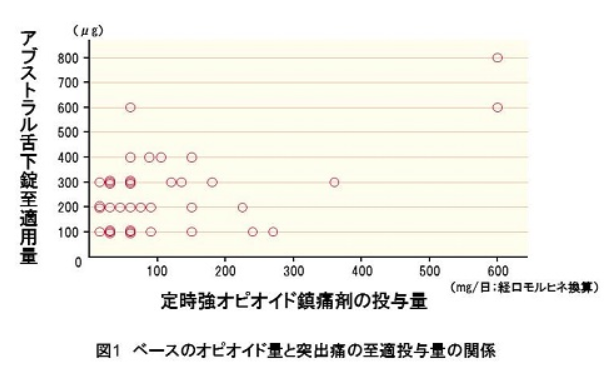
- オピオイド換算表はなく、常に最小量から使用する
突出痛の治療に必要なオピオイドの量は、ベースのオピオイド量とは相関がない→必要量が少ないことも多いこともある
- ◎イーフェンバッカル:頬粘膜吸収錠
- 大鵬製薬が作成した患者向けパンフレットあり
https://www.taiho.co.jp/medical/brand/e-fen/pdf/78DS10J.pdf - メリット:
イーフェンの方が安全域が広い(4時間間隔投与)
超即効が期待できる
置き薬として使用できる - 突出痛の治療に使用される場合、イーフェン200μg≒オキノーム15㎎、が目安
- 最小規格50μgから最高規格800μgまで6規格とラインナップが幅広い
×アブストラルは最小規格100μgで3規格しかない - 薬価:
イーフェンバッカル50μg491円 100μg685円
アブストラル100μg549円 - 投与間隔:
4時間以上のインターバルが必要、1日投与回数の制限(4回まで)もある - 追加投与:
30分後に同量まで1回まで追加投与可能
追加投与は1日の総投与回数にカウントしない
4時間間隔の計測にも追加投与は関与しない→初回投与の間隔で4時間以上あればよい - タイトレーション期には50μgで処方しておく方が便利
50→追加50(合計100)→100→追加50(合計150)→150→追加50~100(合計200~300)のように漸増可能
1回あたりの投与錠数は4錠(左右の上顎臼歯の歯茎と頬との間に2錠ずつ)まで
- 大鵬製薬が作成した患者向けパンフレットあり


- ◎タペンタドール(タペンタ)
CKDにも安全で、副作用も少なく神経障害性疼痛にも有効→オピオイド導入時に最適- タペンタドールはトラマドールの改良版で、中等度から重度の痛みに用いられる強オピオイド
- 経口オキシコドン 20mg = 経口タペンタドール 100mg=トラマドール150㎎=フェントス1㎎
- 規格が25mg, 50mg, 100mg(サイズは統一で17×7×5㎜→デカい!)
- 適応症:
中等度から高度の疼痛を伴う各種癌における鎮痛 - 禁忌:
喘息発作中、重篤なCOPD・呼吸不全、モノアミン酸化酵素(MAO)阻害剤内服中・中止後14日以内 - 開始量:
タペンタ25mg2T2×で開始→用量が増え内服負担が出てきたら(max400㎎まで可)スイッチング
粒がでかいため、実臨床では1回1錠で50㎎/日→100㎎→200㎎の投与が限界だろう - 作用機序:
オピオイドμ受容体作動作用+ノルアドレナリン再取り込み阻害作用→神経障害性疼痛にも有効 - トラマドールの鎮痛効果を高め、副作用を軽減するために開発された製剤
- 腎機能に応じた投与量調節が不要
- 同じ強オピオイドのオキシコドンに比較して眠気や嘔気、便秘の副作用のリスクが低い
- デメリット:
①錠剤がやや大きく飲みにくい
➁レスキューがない

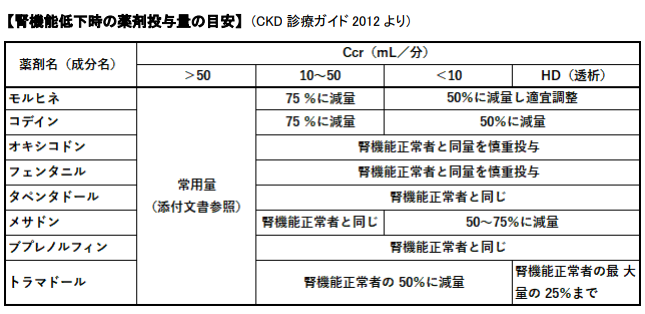
腎不全時のオピオイド
モルヒネ、コデイン、トラマドールは腎不全・透析患者には使用しない方がよい
CKDに推奨されるのは
経口剤:オキシコドン、タペンタ、ナルサス
注射剤:フェンタニル、ナルベイン
貼付剤:フェンタニル、△ノルスパンテープ(ブプレノルフィン)
レスキュー:オキノーム、ナルラピド、レペタン座薬
在宅診療ではCKDでもアンペック坐剤も使用する場合がある→半分に切って(→5㎎)使用も検討
※すでにオピオイド投与中の患者に部分作動薬であるペンタゾシンやブプレノルフィンを使用すると離脱症状や鎮痛効果低下を引き起こす可能性があり
※レペタン(注射、坐薬ともに)の適応症は各種癌・術後鎮痛のみ
※ノルスパンテープは変形性膝関節症・腰痛症に適応があるが癌性疼痛には適応なし
レミッチ®(ナルフラフィン)は透析患者、慢性肝疾患患者のそう痒症治療薬
オピオイドκ受容体に選択的に結合しκ受容体を活性化させることにより、μ受容体に起因する痒みを抑制
直腸癌でMiles術式(直腸部から肛門管、肛門部を切除して人工肛門を造設する術式)による人工肛門の患者に、ジクロフェナクナトリウム坐剤25㎎を単回投与後のCmaxおよびAUCは、健常人の肛門内投与に比べ、いずれも約50%であり、投与後1時間の血漿中濃度は約30%であった報告がある
オピオイド副作用対策
嘔気
オピオイド以外の薬剤性、消化管閉塞、DKA、電解質異常、脳転移などを除外し、想定される機序から制吐薬を選択する
オピオイド減量も検討
制吐剤→ドパミン受容体拮抗薬、消化管蠕動促進薬、第一世代抗ヒスタミン薬から選択
2種類併用がよい
第1選択 メトクロプラミドorハロペリドール(セレネース)
第2選択 レボメプロマジン(ヒルナミン)orオランザピン(ジプレキサ)
第3選択 リスパダール(院内ストックあり)、オランザピン(非定型的抗精神病薬)、クロルプロマジン(コントミン=フェノチアジン系抗精神病薬)、オンダンセトロン(セロトニン拮抗薬)
処方例:
①プリンペラン→食後の嘔気(BBB透過性はプリンペラン>ナウゼリンなのでより効果的かも)
②トラベルミン(ジフェンヒドラミン配合薬)→体動時の嘔気
③ヒルナミンorレボトミン(レボメプロマジン)5mg、分1眠前(半減期15~30時間)→眠くなるので夜に
④セレネース(ハロペリドール)0.75mg、分1眠前(半減期24時間) 適応外使用でオピオイドに伴う吐き気(→今日の治療薬より)
⑤リスパダール
ノバミンは生体内利用率が低く、臨床試験でもプラセボと有意差無く非推奨(緩和ケア医)
結論
制吐剤としてはブチロフェノンもフェノチアジンも使用するがエビデンスの高いデータなし
セロクエルは最もD2遮断作用が弱く制吐作用は期待できない
何も推奨していない
オピオイドが原因で,悪心・嘔吐のあるがん患者に対する制吐薬の 投与は臨床現場では一般的で,推奨すると結論した。しかし,どの制吐薬の投与を 推奨するかについては,合意に至らなかった。さらに,オピオイド投与中のがん患 者の悪心・嘔吐に対して,制吐薬を投与しても悪心・嘔吐が緩和しないとき,オピオイドの変更,投与経路の変更を条件付きで推奨すると結論した。

ハロペリドール(セレネース)
ハロペリドール(セレネース錠 0.75mg®)〔1 回 1 ~2錠 1 日 1 回就寝前〕
レボメプロマジン(ヒルナミン)
健康成人に25 mg経口投与すると、1.5~2時間で最高血中濃度に達する。 半減期は15~30時間
リスパダール
多発性骨髄腫の骨病変
骨病変を認めたらゾレドロン酸を開始,腎障害がある場合はデノスマブを使う
骨髄腫では骨病変が多くの患者に合併し,骨痛や骨折といった骨関連事象(skeletal related event:SRE)のために,患者の生活の質が極度に低下します。さらに進行すれば,高カルシウム血症や脊椎圧迫骨折による脊髄麻痺などが生じ,生命予後も悪化します。一般に,骨病変の存在が認められた場合にはビスホスホネート製剤などの骨修飾薬の治療適応となり,抗骨髄腫治療と併せて治療が行われます。
欧州骨髄腫ネットワークのガイドラインでは,クリアチニンクリアランス(creatinine clearance:Ccr)>30mL/分で骨病変を有する患者にはゾレドロン酸あるいはパミドロン酸の投与が推奨されています1)。ゾレドロン酸は成熟破骨細胞の機能障害やアポトーシス誘導により骨吸収を抑制します。通常,3~4週間に1回,2年間投与することが推奨されています。腎障害がある場合には,Ccrに準じた減量投与が行われますが,Ccr<30mL/分の重度腎機能障害患者におけるエビデンスはないため推奨されません。
鎮静
→国がん式緩和療法を参照(下記)
症状緩和目的に終末期持続鎮静を考慮する際は、必ず多職種でのカンファレンスを開く
- 混注による強度の鎮静+鎮痛+呼吸困難の改善
- ◎モルヒネ+ドルミカム持続皮下注
- モルヒネ注2A(2mL)+生食8mL+ドルミカム注5A(10mL)=20mL
- 0.5mL/hrで持続皮下注開始
- ドルミカムの院外処方はできない→在宅クリニックで保管が必要
- セレネース
- ブスコパン
- リンデロン(デカドロン)


https://www.seirei.or.jp/mikatahara/doc_kanwa/contents6/32.html
https://www.jspm.ne.jp/files/guideline/sedation_2018/05_05.pdf
- ブロマゼパム坐薬3mg(セニラン):
- 適応症:麻酔前投薬のみ
- Cmaxは投与後3時間
- 鎮静効果は同薬坐薬3㎎=同薬経口5㎎
- ダイアップ座薬4、6、10mg(ジアゼパム):
皮膚浸潤性腫瘍の出血・悪臭
出血→圧迫+ボスミンガーゼ+アルギン酸ドレッシング剤(カルトスタット)+トロンビン+Mohs軟膏
悪臭には洗浄+ロゼックス軟膏(メトロニダゾール)



胸水・腹水
- 利尿作用は持続時間からアゾセミド60㎎1T>フロセミド20㎎
- 低アルブミン血症→RAA系亢進→腎不全なければスピロノラクトン併用がベター
- 栄養状態が良好ならCARTしなくてもよい→穿刺排液のみ
腸閉塞

腫瘍熱
ナイキサン+カロナール+デカドロン
内服が難しい場合は座薬(ボルタレン、)、ジクトルテープ75㎎/枚→癌性疼痛は最大3枚(非癌性疼痛は最大2枚)まで同時使用可能
がん患者の腫瘍熱は 5-27%と報告され、転移巣が多いほど腫瘍熱をきたしやすい。
診断基準(明確なものではない):
1)37.8℃以上の発熱が 1 日 1 回以上ある。
2)発熱の期間が 長期間である(おおよそ 2 週間以上)。
3)身体診察・検査所見 (培養検査を含む)・画像検査などにおいて感染症の根拠を認めない。
4)アレルギーによる発熱は否定的である。
5)感染が疑わしい場合、7 日以上の経験的な抗菌薬治療に対する解熱反応がない。
6)ナプロキセンテストによって速やかに完全に解熱し, ナプロキセンを使用中平熱が持続する。
対症療法:
●ナプロキセン(ナイキサン🄬)400~600mg 分 2~3 を定期投与することが勧められている。これで 12~24 時間後から丸 1 日を通して解熱すれば腫瘍熱と診断する。ナプロキセンが有効でない場合、他の解熱作用のあるNSAIDs(フルルビプロフェンアキセチル(ロピオン🄬)、ジクロフェナクナトリウム(ボルタレン🄬)、ロキソプロフェン(ロキソニン🄬))に変更することが有効な時がある。セレコキシブ(セレコックス🄬)といった COX-2 選択阻害薬は解熱効果が弱いため使用しない。またアセトアミノフェン 2.4~4.0g 分 3~4 を使用・併用することも可能である。
●上記の対応で症状緩和が困難である場合や食思不振・倦怠感など悪液質による症状がある場合は、少量のステロイド(デキサメサゾン・ベタメタゾン 2~4mg/回、ハイドロコルチゾン 100mg/回)を投与する事も検討できる。しかし、感染が完全に否定できない場合や 1 カ月以上の投与になる場合には、消化性潰瘍、血糖異常、ムーンフェイス、精神症状(不眠、せん妄、抑うつ)、易感染、ミオパチーなどの合併症を生じるリスクがある。またステロイド投与中に発熱が再発した場合、不顕性の感染が顕性化した可能性が高いので、感染の再検索が必要と思われる。
出典:http://www.kanwa.med.tohoku.ac.jp/student/pdf/manual/2019/04.pdf
悪心(嘔気)・嘔吐
制吐剤の持続皮下注について
ハロペリドールが皮下組織への障害性も少なく第一選択(それでも4割で皮下硬結でる)
メトクロプラミドもよいが消化管閉塞では禁忌
クロルプロマジン,プロクロロペラジン,レボメプロマジンについては皮下組織の障害が起こるので持続皮下注では使うべきでない

- ドパミン受容体阻害薬
- メトクロプラミド◎ がん患者の嘔気に対するエビデンスあり
- ドンペリドン○ エビデンス少ないがメトクロ=ドンペリドンと考えられる
- 抗精神病薬◎→ブチロフェノン系を主に用いる
- フェノチアジン系〇
- クロルプロマジン(ウインタミン、コントミン) 眠気強い
- レボメプロマジン(ヒルナミン) エビデンス少ない 眠気強い
- プロクロルペラジン(ノバミン) エビデンス少ない
- ブチロフェノン系(ハロペリドール◎◎)
- フェノチアジン系〇
- 非定型抗精神病薬△ エビデンスには乏しい
- オランザピン
- リスペリドン
- 5-HT3受容体阻害薬◎
- コルチコステロイド△ 意外とエビデンスに乏しい
- H1受容体阻害薬△ エビデンスは少ないが体動時の前庭系が原因の嘔気に有効な可能性がある
- ヒベルナ
- クロルフェニラミン
- ジフェンヒドラミン
- ヒドロキシジン塩酸塩
- 抗コリン薬△ エビデンスは少ないが体動時の前庭系が原因の嘔気に有効な可能性がある
抗精神病薬について
ブチロフェノン系抗精神病薬はフェノチアジン系と比較すると、アドレナリンα1受容体阻害作用や抗コリン作用、抗ヒスタミン作用は弱い一方で、錐体外路症状(錐体外路障害)が出やすいことや、長期服用で遅発性ジスキネジアの問題もある。


オピオイドの嘔気にはトラベルミンが第一選択
がん終末期の精神症状
緩和ケア病棟に入院した終末期がん患者 93 名(平均年齢 67±12 歳,がん罹病期間20.2±34.5 カ月)では,53.7%に精神医学的診断が認められた
せん妄(28%),適応障害(7.5%),うつ病(3.2%)の順
- がん患者に おけるPHQ-9を用いた大うつ病性障害のスクリーニングに関する研究:
- Thekkumpurathらが 4264 人のを施行し,カットオフ8 点以上とした場合→感度 93%,特異度 81%
- Hartung らは,2141 人のがん患者に施行しカットオフ7 点以上とした場合→感度 83%,特異度 61%
せん妄
興奮が少ない過活動型せん妄
ベッド上でゴソゴソ→トラゾドン(レスリン、デジレル):1回25mg、30分あけて2~3回まで
トラゾドンでは不十分→ミアンセリン(テトラミド):より長時間、かつ強力に作用、1回10~20mg
興奮が強い過活動型せん妄
セロクエル(クエチアピン)が有効、パーキンソン病に対する投与も許容されている
糖尿病の患者ではリスペリドン(リスパダール)内用液を使用する
リスパダールは茶葉系(お茶、紅茶)やコーラと混ぜると効果減弱する→みそ汁はOK。
糖尿病+腎不全ではペロスピロン(ルーラン)を使用する
オランザピンはOD錠があるため、溶かして飲ませることができる
持続皮下注における注意事項
皮下硬結
- 皮下硬結が発生すると薬剤の吸収性が不安定となると報告されている
- 硬結発生の原因としては穿刺針の針先の位置の影響も報告されている
配合変化(ハロペリドール)
- ヒドロモルフォンの医薬品インタビューフォーム
ヒドロモルフォン 2mg+ハロペリドール 5 mg+生理食塩水 50 ml の混合では配合変化はおきなかった - ハロペリドールの医薬品インタビューフォーム
ハロペリドール 5 mg を 5%ブドウ糖液 0.5~2 mlと混じた場合は時間が経過しても外観に変化はなかったが,生理食塩水 2~3 ml と混じた場合は 24 時間後に結晶析出があった - Storey らもハロペリドールを 5%ブドウ糖液で 1~3 mg/ml としても混濁は生じなかったが,生理食塩水に混ぜると混濁を生じる場合があるとしている
在宅診療で処方できる注射薬

