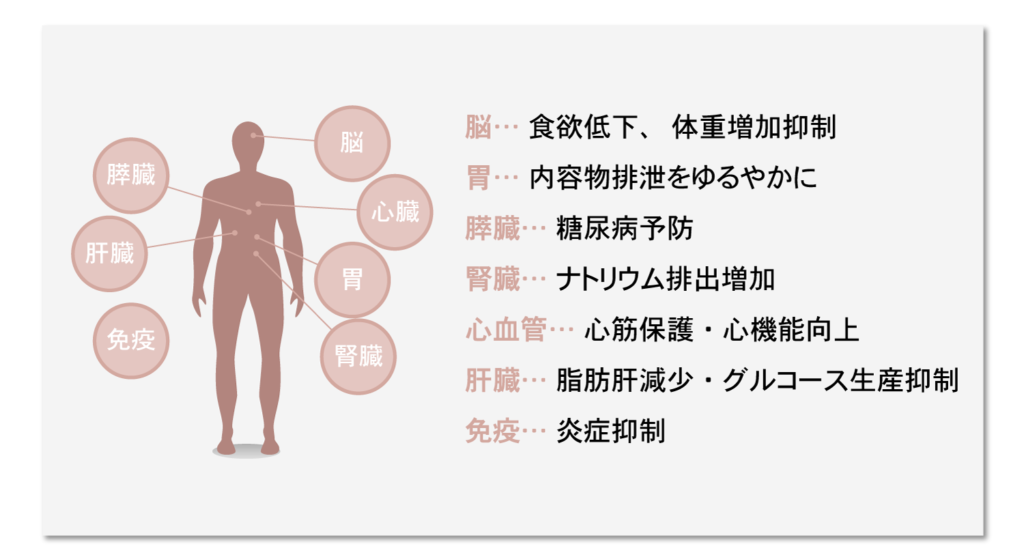
身体所見
- 毎回の外来でFOLLOWすること→脈拍、血圧、体重、呼吸音、心音、体温、下肢、意識、腹部など
- 血圧、体重、心拍数と脈、呼吸音、心音、SPO2
- RAS阻害薬の処方時には、腹部に血管雑音がないかチェック(腎動脈狭窄)
一般内科診療
マルチモビディティ
- 複数の慢性疾患が併存している状態のこと
- それぞれのガイドラインをそのまま通用しない
- ポリファーマシーに陥る
肥満/肥満症
- ウゴービ皮下注(セマグルチド)(ノボ・ノルディスク:デンマーク):米国ではすでに販売されている
- 2023年4月に保険適用、発売日は未定
- 糖尿病治療薬よりも高容量投与が可能
医薬品はその分子量により低分子、中分子、高分子医薬品に分類される。高分子薬は抗体医薬やワクチンなどの分子量が大きい(10000くらい)薬品のこと(バイオ医薬品とも)で分子量が大きく消化・吸収の影響をまともに受けるため経口投与できず注射剤として使用される。また分子量の大きさから細胞内に入ることができないので細胞表面タンパク質か、血中に存在する分泌タンパク質が標的分子となる。特異性は極めて高く一般に副作用が少ない医薬品とされるが、開発や生産にコストがかかる。
GLP-1受容体作動薬は、ペプチド構造で分子量が4000程度と大きいため、胃からの吸収が難しく、さらに消化酵素によりすぐに分解されてしまうため経口薬の創薬は困難と考えられていた。サルカプロザートナトリウム(SNAC)と呼ばれる吸収促進剤を添加することで、SNACと経口セマグルチド(GLP-1受容体作動薬)の複合体が、ペプシンにより分解されにくくなり胃からの吸収が促進され、経口で十分な効果を発揮できるように開発された。経口セマグルチドは一日一回経口投与、つまり口から飲むだけでいいという、他の注射薬とは一線を画す特徴を持った薬だが、吸収率を安定させるため早朝空腹時に服用し、服用後30分間は飲食できないという制限がある。
メタボリックシンドローム
- 心血管疾患発症を効果的に予防するために策定された(1998年~、WHO)
- 日本でのメタボリックシンドロームは「内臓脂肪蓄積を基盤とした心血管リスクの集積」
- 日本の関連学会8つが協議して2005年に診断基準を作成(8学会策定新基準)
- 20 歳以上においてメタボリックシンドロームが強く疑われる者は940万人(人口比率では男性24.5%、女性10.3%)、予備群と考えられる者は1020万人(男性22.8%、女性8.3%)である
- 40~74歳でみると、およそ男性の2人に1人、女性の5人に1人が「メタボリックシンドロームが強く疑われる者」または「予備群と考えられる者」である
- 2008 年 4 月より40~74歳の被保険者・被扶養者を対象とする内臓脂肪蓄積型肥満に着目した健康診査及び保健指導(特定健康診査・特定保健指導)が全国で開始され2013年度より第2期を迎えた
- NAFLDは心血管イベントにおける独立した発症リスク、メタボやDM患者ではNAFLDにも注意が必要

- 国際的な診断基準策定を目指して2009年、国際糖尿病連盟(IDF)より腹部肥満を必須としない新診断基準が提唱された
腹囲高値は必須項目から外され、次の5項目のうち3項目が該当すればメタボリックシンドロームと診断する
- 腹囲高値 集団別・国別の基準を使用
- 中性脂肪高値 150mg/dL(1.7mmoL/L)以上
- HDL-C低値 男性:40mg/dL(1.0mmoL/L)未満、女性:50mg/dL(1.3mmoL/L)未満
- 血圧上昇 収縮期血圧:130mmHg以上および/または拡張期血圧:85mmHg以上
- 空腹時血糖高値 100mg/dL以上
日本内科学会、日本肥満学会、日本動脈硬化学会、日本糖尿病学会、日本高血圧学会、日本循環器学会、日本腎臓学会、日本血栓止血学会の8学会が日本におけるメタボリックシンドロームの疾患概念と診断基準を策定し2005年4月に日本内科学会総会で公表した。
肥満症は「肥満(BMI(body mass index)≧25)を基盤とした健康障害の合併」
メタボリックシンドロームは「内臓脂肪蓄積を基盤とした心血管リスクの集積」
という違いがある。
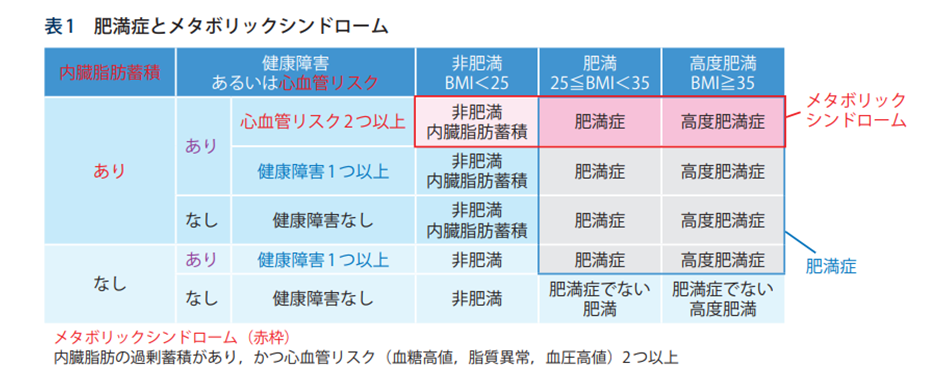
上表のとおり、内臓脂肪型肥満だけではリスク因子とはならない
メタボリックシンドロームへの介入
- 低エネルギー食
- 脂肪制限、とくに飽和脂肪酸の制限
- 低GI食(白米84に対し玄米は55)
- 運動→基礎代謝をあげ、インスリン抵抗性を改善させる
1週間に23エクササイズ以上の運動を目指す(エクササイズ=METS×時間)
EX)8METSを3時間で24エクササイズ(1日30分の運動を週6日行う) - ファイトケミカルの摂取
- アンチメタボのサプリ→水溶性食物繊維など
- 禁煙、禁酒
糖尿病
- 日本人の糖尿病はインスリン分泌低下>インスリン抵抗性で欧米のインスリン抵抗性主体の糖尿病とは病態が異なる(日本人2型糖尿病は肥満と非肥満が半々)→BMI>25はインスリン抵抗性が主体、BMI<25はインスリン分泌不全(インスリン分泌不全→糖代謝不全で痩せてくる)を想定する
- 2017年の調査で日本で最も使用されているのは①DPP-4阻害薬、②ビグアナイド、③SGLT2阻害薬で、DPP-4阻害薬はとくに高齢者糖尿病の第一選択薬として頻用されている(地域差、施設間格差が大きい)
病態・疫学・基本
- →「糖尿病標準診療マニュアル2022」(日本糖尿病・生活習慣病ヒューマンデータ学会)を参照する
- インスリン作用不足による慢性の高血糖状態を主徴とする代謝症候群
- 1 型糖尿病:自己免疫性に膵β細胞が破壊されることがインスリン作用不足の主因
- 2 型糖尿病:β細胞量の減少によるインスリン分泌低下やインスリン抵抗性をきたす素因を含む複数の遺伝因子、過食・運動不足 ・ 肥満などの環境因子、加齢などが関係している
- DMでは血管病だけでなく、アルツハイマー病、ガン、肺炎、骨粗鬆症、変形性関節症などの老年疾患の発症リスクも高まる
- 世界で5億3700万人(2021年、IDF糖尿病マニュアル)、耐糖能異常もさらに5億4200万人いる
- 日本の糖尿病患者は1000万人、予備軍1000万人で合計2000万人と言われている
- 日本独自→JDS値、国際標準→NGSP値 であったがNGSPで統一された(2013年~)
換算式 JDS値+0.4=NGSP値 - 糖尿病治療に世界で100兆円(世界の医療費の15%)が投入され、670万人/年が死亡している
- AGEsが組織に蓄積することで機能障害をもたらす、一度形成されるとゆっくりしか代謝できない
- 1型も2型も病初期の厳格な血糖コントロールがのちの予後に大きく影響する(DCCT試験、UKPDS80試験)
- スクリーニング対象者は45歳以上のBMI>25 or HT+、HL+の人(糖尿病学会)
- スクリーニング方法は空腹時血糖+HbA1c
- 糖尿病性腎症初期の指標は早朝尿中アルブミンが鋭敏
- 初回インスリン1日総投与量 0.1~0.2単位 /kg
- 超速効型インスリンは食直後うちでも、食直前うちとあまり効果に差はない
- 静脈栄養患者:ブドウ糖8gに対してRを1単位の割合でインスリンを開始 (肥満者/手術後/ステロイド使用中などではブドウ糖5gに1単位になるようにmodify)
- 〔伊藤の計算法〕 1 日インスリン総量(単位)=(空腹時血糖値-20)÷10 ただし、この式で算出されたインスリン量の上限は 20 単位とする。
- 基礎インスリン量(Basal 量)は、体重を目安として次の式で求め、遅効型または超遅効型のインスリンを用いる
- 基礎インスリン量(単位)=患者の体重(kg)÷5
- 強化インスリン療法の場合、インスリン量は朝>夕>昼の順で配分する
- 超速効型インスリンを使用して、間食時や血糖値上昇時の補正を目的として、少量(2~3U) の Bolus 投与を行う
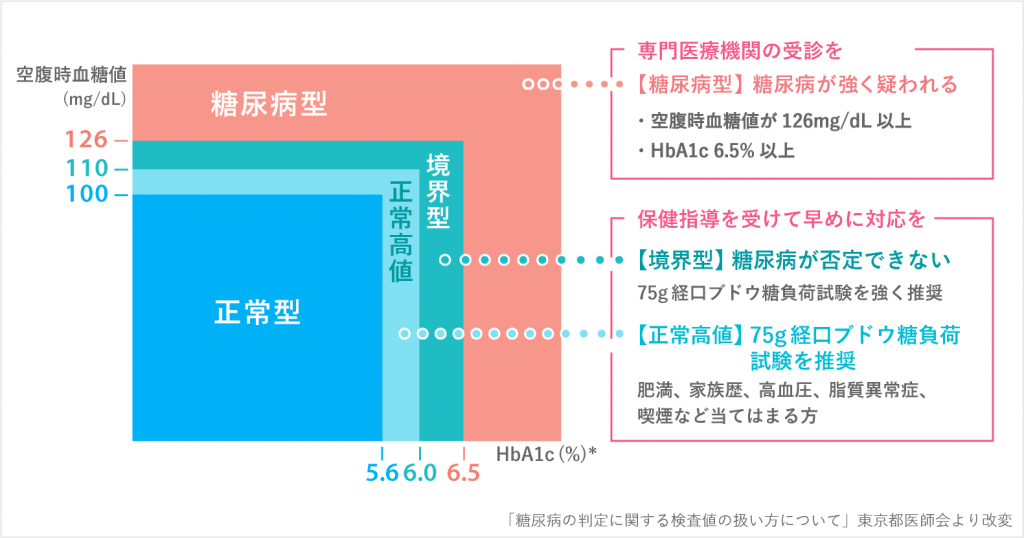
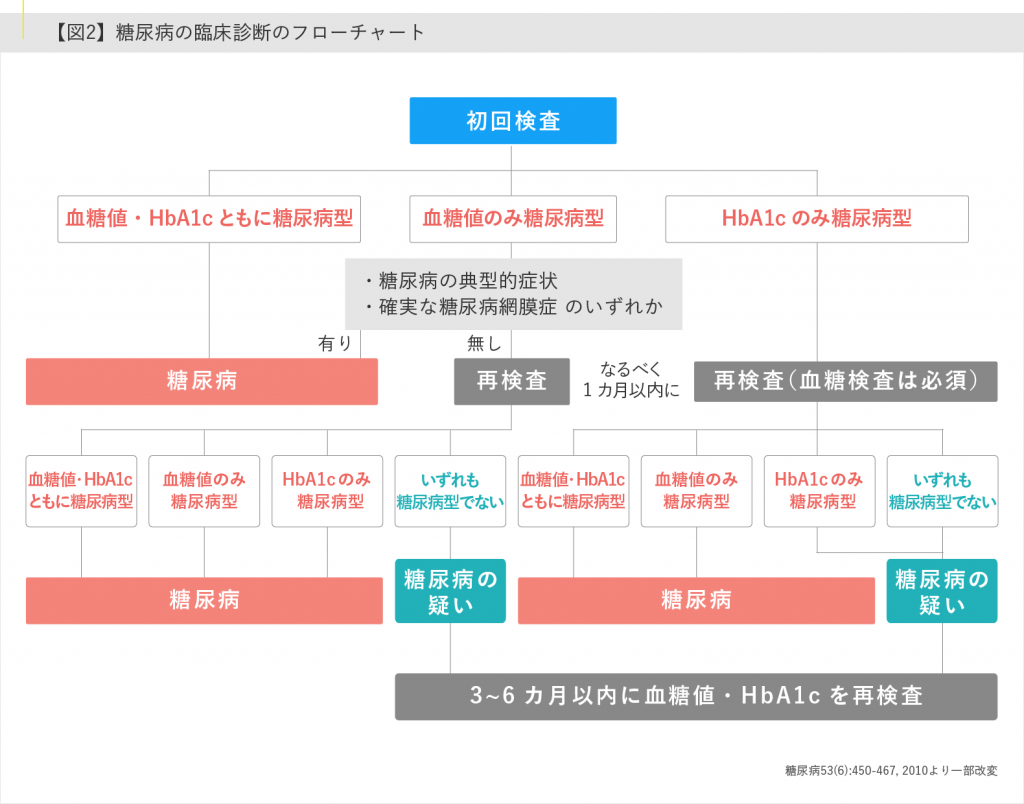
診断基準(糖尿病標準診療マニュアル2022)
1.①早朝空腹時血糖値 126 mg / dl 以上, ② 75 g 経口ブドウ糖負荷試験(OGTT)2 時間値 200 mg/ dl
以上,③随時血糖値 200 mg / dl 以上, ④ HbA1c 6.5%以上,のうち①~③のいずれかと④が確認
されれば,糖尿病と診断する[註:ストレスのない状態での高血糖の確認が必要]
2.①~④のいずれかひとつだけを認めた場合は「糖尿病型」と診断する.別の日に再検査を行い,
再び「糖尿病型」が確認されれば糖尿病と診断する.ただし,HbA1c のみの反復検査で糖尿病と
診断することは不可とする
3.血糖値が「糖尿病型」(①〜③のいずれか)を示し,かつ次のいずれかの条件が満たされた場合は糖
尿病と診断する
・糖尿病の典型的症状(口渇,多飲,多尿,体重減少)の存在
・確実な糖尿病網膜症の存在
4.過去において,上記 1.〜 3.の条件が満たされていたことが確認できる場合には,現在の検査値が上
記の条件に合致しなくても,糖尿病と診断するか,糖尿病の疑いをもって対応する
5.上記 1.〜 4.によっても糖尿病の判定が困難な場合には,糖尿病の疑いをもって患者を追跡し,時
期をおいて再検査する
管理目標
コントロール目標はHbA1c<7.0%、空腹時血糖<130㎎/dL、食後2時間値<180㎎/dL
コントロール良好の場合は、無症候性の夜間低血糖などがないか、注意する
糖尿病の診断・治療と同時にDM性合併症の評価が必要(腎、網膜、神経)

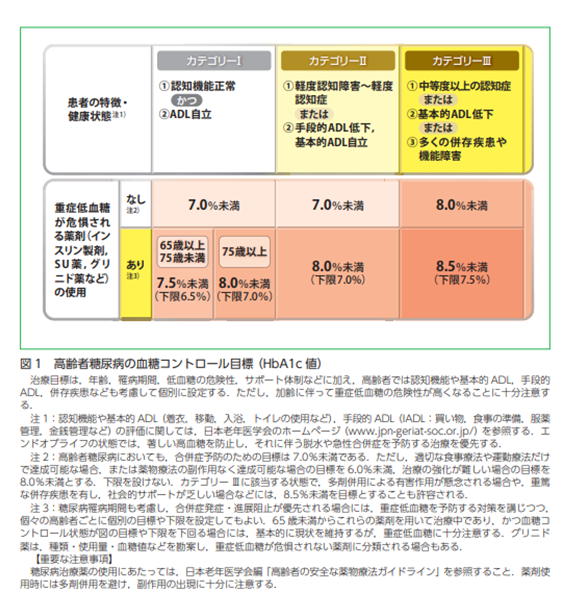
高齢者糖尿病→認知機能やADL、合併症に基づいてカテゴリーごとの治療目標がある(高齢者糖尿病治療ガイド2021:日本糖尿病学会・日本老年医学会)→カテゴリー3ではHbA1c8.0~8.5未満が管理目標とゆるく設定されている
- 3大合併症である細小血管症(網膜症・腎症・神経障害)の予防
- 神経障害→網膜症(5年)→腎症(10年~)の順に発症する
- 2型DMでは腎症発症まで10~20年と言われている
- 神経症や網膜症がない糖尿病患者のCKDはDKDでない(糸球体疾患など)可能性が高い
- 糖尿病性合併症による死亡率の改善
- 管理目標(絶対的指標ではない、高齢者におけるエビデンスはない)
- 体重 BMI 25 kg/m2 以上の場合:3%以上の減量(BW60㎏なら1.8㎏)
- 血圧 診察室血圧 130/80 mmHg(家庭血圧 125/75 mmHg)未満
- 血糖 HbA1c 7.0% 未満(グリコアルブミン約 20%未満)
- 空腹時血糖 130 mg/dl 未満
- 脂質 LDLコレステロール 120 mg/dl 未満;冠動脈疾患を合併する場合は 100 mg/dl 未満
- 早朝空腹時中性脂肪 150 mg/dl 未満
- HDLコレステロール 40 mg/dl 以上
- 2型DMではHbA1c、血圧、LDLコレステロール、尿中Alb、喫煙の5つのリスク因子を目標範囲内に管理すれば心血管イベントは健常人とほぼ変わらないことが証明された
定期的に行う検査
- SMBGとCGM→低血糖管理にも有用
- ともにインスリンもしくはGLP-1受容体作動薬を注射している患者が保険適応
- SMBG→精度については10%の誤差がある
- CGM→皮下組織液のグルコース濃度から推測した血糖値で乖離することがある
- FBGが基準値なのにHbA1cコントロール不良の場合は食後高血糖が示唆されるためSMBGやCGMが推奨
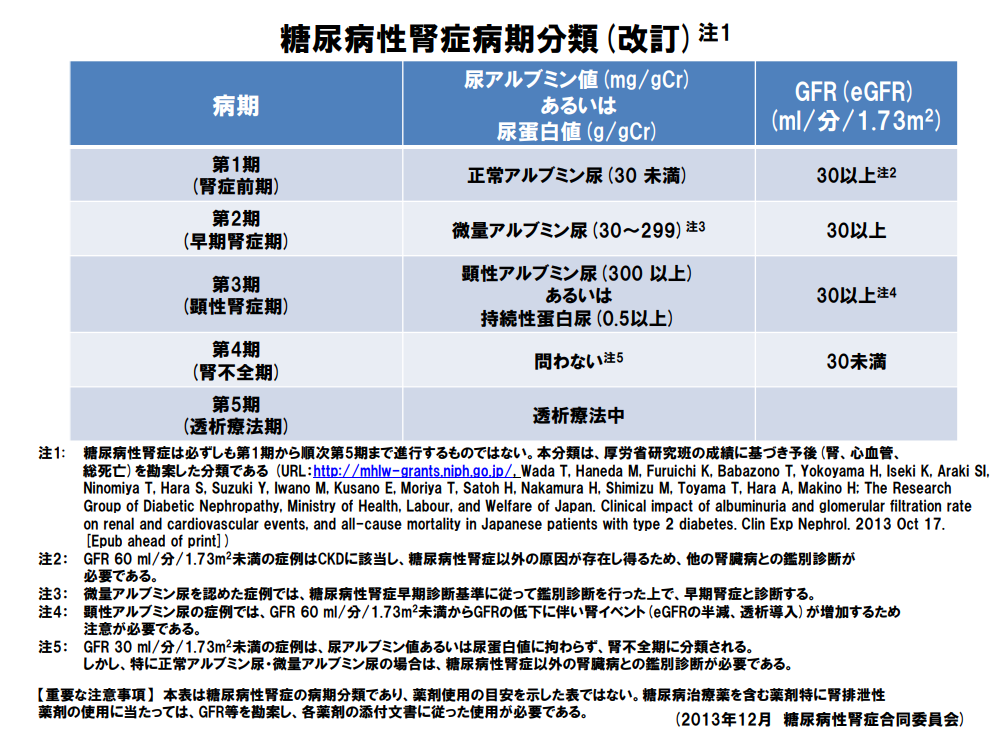
- 糖尿病性腎症のFOLLOW→認定教育施設でも実施率54%(非認定教育施設での実施率はわずか18%)
- 糖尿病性腎症の病気分類に従う
- 微量アルブミン尿とeGFR:3~6か月ごとにFOLLOW
- アルブミン尿の増加を伴わずにeGFR低下が先行するタイプが存在する(→DKD:糖尿病性腎臓病と称する)
- 薬物療法はRAS阻害薬(ACEI=ARB)+MRA阻害薬(ケレンディア)+SGLT2阻害薬(フォシーガ)+GLP-1作動薬
- SGLT2阻害薬は日本腎臓学会ガイドラインでDKDに対して強い推奨
- 腎性貧血の治療も重要→ESA製剤やHIF-PH阻害薬
- 糖尿病性網膜症(DR:diabetic retinopathy)のFOLLOW
- 自覚症状がなくても眼底検査が必要
- 糖尿病歴5年以上でDR発症リスクが高まる
- DRは失明原因の第3位(1位→緑内障、2位→網膜色素変性)
- 糖尿病性神経障害(DPN:diabetic polyneuropathy)のFOLLOW
- 問診と神経診察が重要→簡易診断基準→軽症例では年1回のチェックでOK
- 糖尿病では多彩な神経障害をきたすが最も多いのがDPN(DM患者の30~40%に合併)
- DPNでは左右対称性、長さ依存性に生じる→両足趾・足底のしびれ感、疼痛、異常感覚→感覚鈍麻→足内在筋の萎縮と筋力低下、自律神経障害として起立性低血圧、便秘・下痢、神経因性膀胱、発汗異常など
- 治療:
- 血糖コントロールが重要、病初期におけるDPN進展予防にはキネダック(エパルレスタット)
- 有痛性神経障害にはリリカ、サインバルタ(DPNに保険適応あり)、トリプタノール
※非定型抗精神病薬(MARTA:ジプレキサ、セロクエル)は糖尿病禁忌 - 起立性低血圧治療にはメトリジン(ミドドリン)、フロリネフ(フルドロコルチゾン)
- 心電図検査:
- 冠動脈疾患のスクリーニングに最適、年1回実施
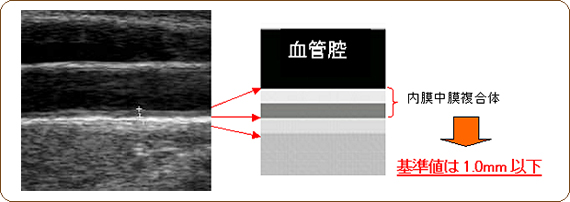
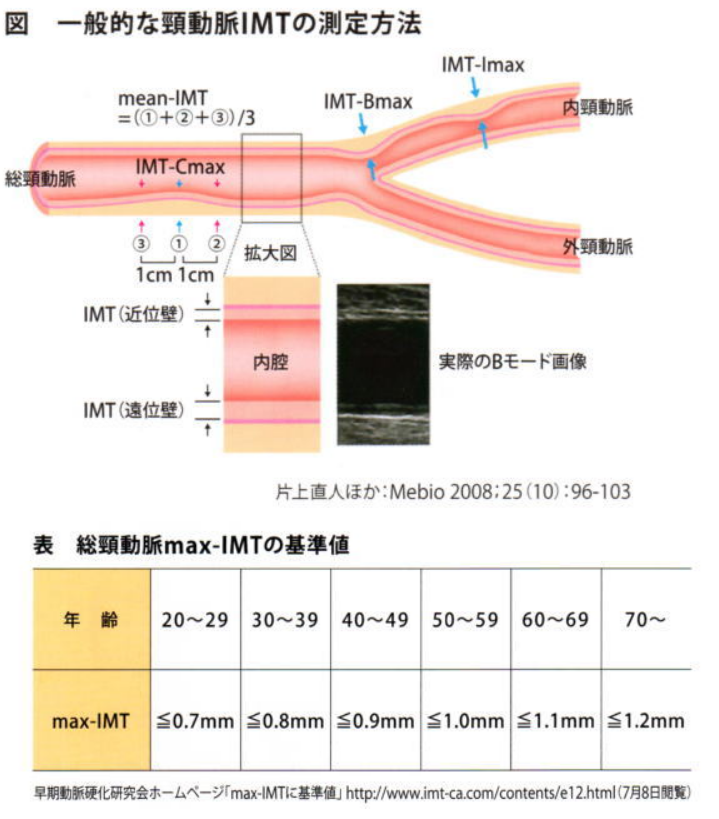
- 頸動脈エコー検査:
- 頸動脈内膜中皮肥厚(IMT:Intima Media Thickness)は動脈硬化性疾患の良い指標
- 正常は1.0㎜以下で1.1~肥厚ありとなる
- 総頚動脈(IMT-Cmax)、頚動脈洞・頚動脈分岐部(IMT-Bmax)、内頸動脈(IMT-Imax)各領域でプラークを含む最も肥厚した部分の最大値をMAX-IMTとする
- ABI:足関節上腕血圧比
- <0.9は異常、標準値は0.91~1.4
- ABIの正常値は 1.0~1.40 で,0.91~0.99 は境界領域である
- 0.9 以下では有意な閉塞性病変の存在を疑う
- ABIが 1.4 を超える場合は,下肢動脈の石灰化が強いため測定カフにより血管が圧迫されず,偽の上昇を来していると判断され,糖尿病あるいは維持透析患者にしばしばみられる.
- CAVI、PWV:血管硬化指数
- PWV(脈波伝播速度)は測定時の血圧の影響を受け,CAVI(心臓足首血管指数)は血圧の影響を殆ど受けない
- PWV(pulse wave velocity):
- 脈波が動脈壁に伝わる速度のことで、上腕動脈と足関節動脈の二点の脈波を測定値と距離の差から計算する。
- CAVI(cardio-ankle vascular index):
- 心臓から足関節までの脈波の速度から、動脈全体の硬さを調べる指標
- CAVI < 8.0で動脈硬化あり、正常は>9.0
- フットチェック
- リスクに応じてカテゴリー分け(足病変のリスク分類:IWGDF)
- リスクなし→年1回、最高リスク→1~3か月に1回はフットチェックを行う
- 難治性病変→フットケア専門外来にコンサルト

管理料

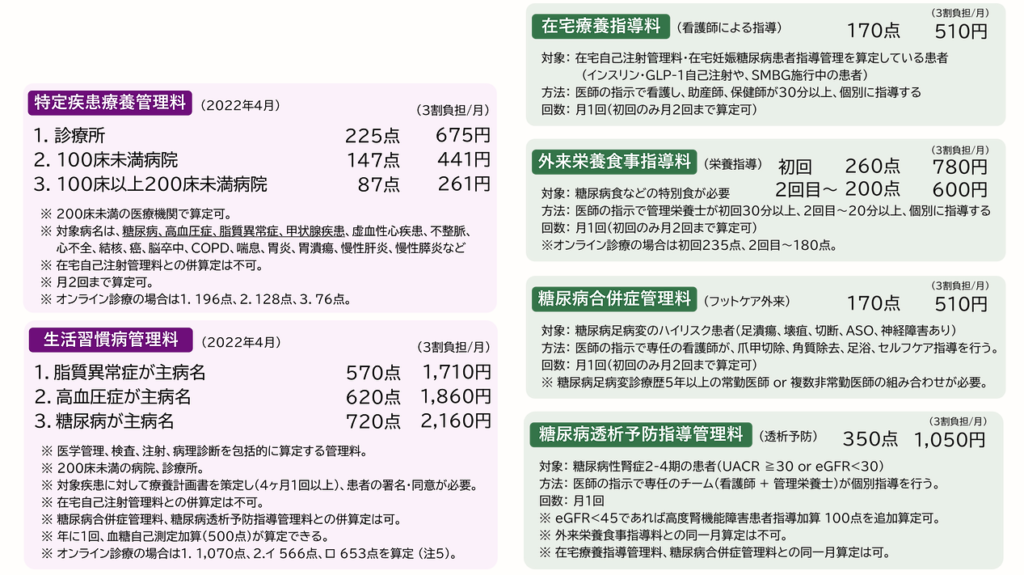
治療→食事療法+運動療法が基本±薬物療法
血糖管理だけではなく、脂質異常、血圧とセットで管理する必要がる
インスリン非依存状態(主に2型糖尿病)において、「代謝障害が中等度以下の場合(血糖値250~300mg/dL程度またはそれ以下、HbA1cでは9.0%未満)、食事療法と運動療法を行う。生活習慣改善に向けての糖尿病教育を行う」「2~3カ月間程度継続しても、目標の血糖値を達成できない場合には、経口血糖降下薬またはインスリンやGLP-1受容体作用薬などの薬物療法を行う」
→糖尿病診療ガイドライン2019 および 糖尿病治療ガイド2022-2023
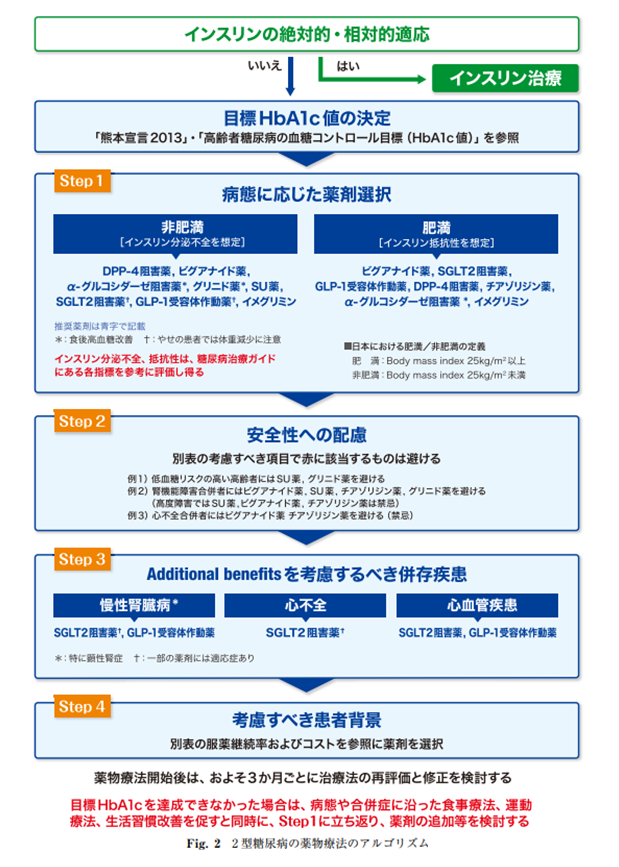
日本糖尿病学会2023.1
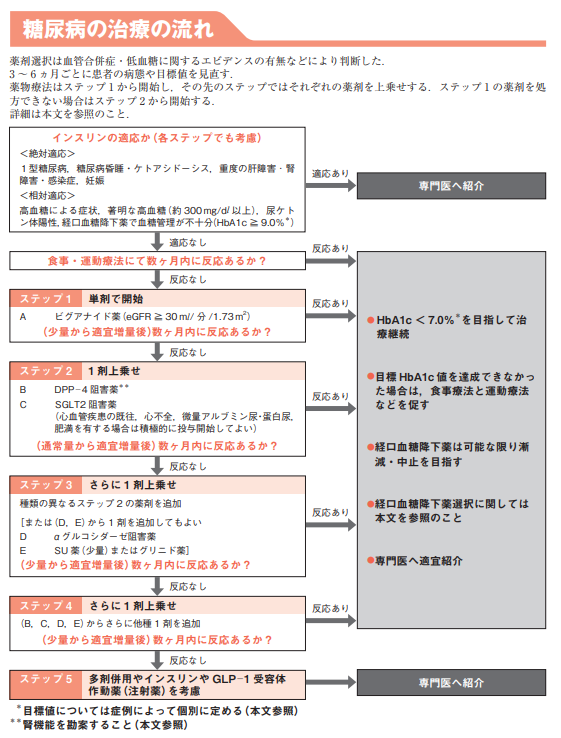
日本糖尿病生活習慣病ヒューマンデータ学会

- 食事療法(日本糖尿病学会編: 糖尿病食事療法のための食品交換表 第 7 版 参照)
- 目安とする総エネルギー摂取量(kcal)=目標体重×エネルギー係数
- BMI 25 kg/ m2 以上の場合、3%以上の減量を達成するようにエネルギー量を調整する

- 運動療法 →有酸素運動+筋トレを基本セットとして行う
- 歩行なら 1 回 15〜 30 分間、1 日 2 回(1 日の歩数約 8,000 〜 9,000 歩)、週に 3 日以上が望ましい
→従来よりも短い距離でも効果がある - 日常生活において身体活動量を増やすだけでも長期間継続すれば効果がある
- レジスタンス運動(=筋トレ)も血糖コントロールに有効であり歩行運動などと併用すると相加効果がある
- 運動禁止 ・ 制限が必要な場合
空腹時血糖値 250 mg / dl 以上,尿ケトン体陽性,眼底出血,腎不全,心疾患,骨 ・ 関節疾患,壊疽,急性感染症,高度の自律神経障害など - 有酸素運動:有酸素運動は最大酸素摂取量を増加させ、インスリン抵抗性を改善させる
最大酸素摂取量の多い人は 2 型糖尿病を発症するリスクが低い
有酸素運動で筋細胞への血流が増加→血中のブドウ糖を細胞の中に取り込む(インスリン非依存的)
- 筋トレ:基礎代謝量が上がり減量→インスリン抵抗性の改善→血糖値低下
- 順番は筋トレ→有酸素運動がより効果的
- 運動ではなくNEAT(non-exercise activity thermogenesis)を増やすこと(座位時間を減らす)も重要
- 歩行なら 1 回 15〜 30 分間、1 日 2 回(1 日の歩数約 8,000 〜 9,000 歩)、週に 3 日以上が望ましい
- 骨格筋は体重の約半分を占める人体最大の器官で、血糖の80%以上は骨格筋によって取り込まれる
- 骨格筋量が減ることは、糖質が消費できず耐糖能の悪化に直結する
- インスリンは骨格筋の血糖取り込みを亢進させる(インスリン刺激→筋細胞膜上のGLUT4発現促進→ブドウ糖取り込亢進)
- 運動時の筋収縮による糖取り込み亢進はインスリン非依存的(運動でGLUT4がインスリン非依存的に発現する)
- 運動は膵臓のインスリン分泌を促進することなく、血糖降下させる
- 筋収縮はAMPKを活性化することによりGLUT4をトランスロケーションさせている?(仮説)
- 運動などによるインスリン抵抗性の改善は、糖尿病だけでなくメタボリックシンドローム、高血圧、脂質異常症、非アルコール性脂肪性肝疾患などの生活習慣病の予防と改善に寄与する
- 骨格筋から産生・分泌されるマイオカインのひとつである interleukin-6(IL-6)はAMPK 活性化を介して筋での糖取りこみや脂肪酸酸化を促進させることが報告されている
- 運動はインクレチン(GIPやGLP-1)分泌を促進することも報告されている
マイオカインとは、骨格筋(筋肉)から分泌される生理活性物質(サイトカイン)の総称。 ギリシャ語のmyo(筋)とkine(作動物質)を組み合わせて作られた造語。 近年、研究が進み、「運動と健康」の仕組みを解明するカギとなる物質として注目を集めている
動脈の硬さは、動脈壁の構造(器質的因子)だけでなく血管平滑筋の緊張状態(機能的因子)によっても変化し、動脈の硬さの進展は心血管疾患の発症と関連する。血管平滑筋の緊張状態は有酸素運動では和らぎ、レジスタンス運動では増加する。動脈の硬さを和らげる観点でも、運動の順番はレジスタンス運動→有酸素運動の順番が適している。
→出典https://www.jstage.jst.go.jp/article/rigaku/43/6/43_43-6kikaku_Igaki_Makoto/_pdf
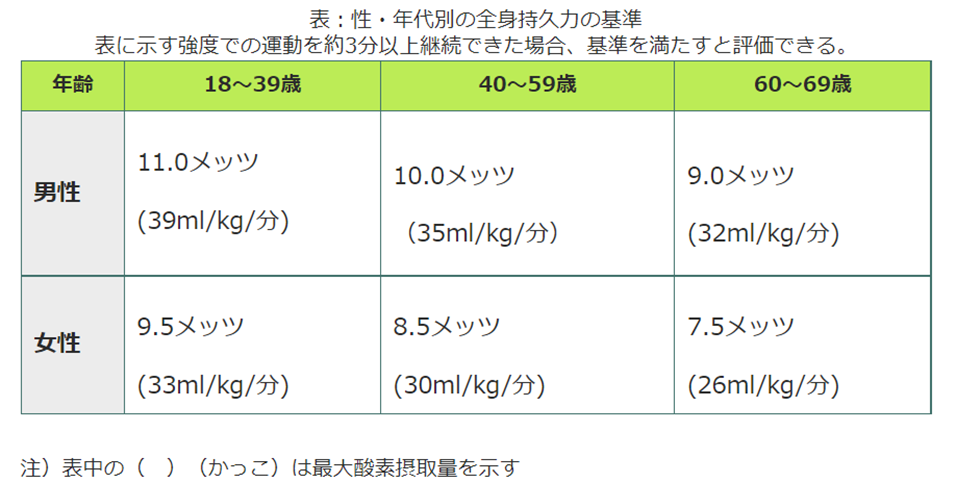
1分間に体重1kgあたり取り込むことができる酸素の量(ml/kg/分)。「VO2max」のVはVolume。厚労省「健康づくりのための運動基準2013」では、性・年代別の基準値が定められている(下表)。最大酸素摂取量の測定は呼気ガス分析法にて行う(徐々に運動強度を高めていき酸素摂取量の増加がみられなくなった量が最大酸素摂取量)。最大酸素摂取量は全身持久力の指標となるので、最大酸素摂取量を高めるには全身を使って一定時間動き続ける有酸素運動が効果的。最大酸素摂取量は除脂肪体重と関連するため、有酸素運動に筋力トレーニングをプラスすることでさらなる効果が期待できる。1MET(安静座位時)=3.5mL/kg/分と定義されている。METsとはMetabolic Equivalentsの略。
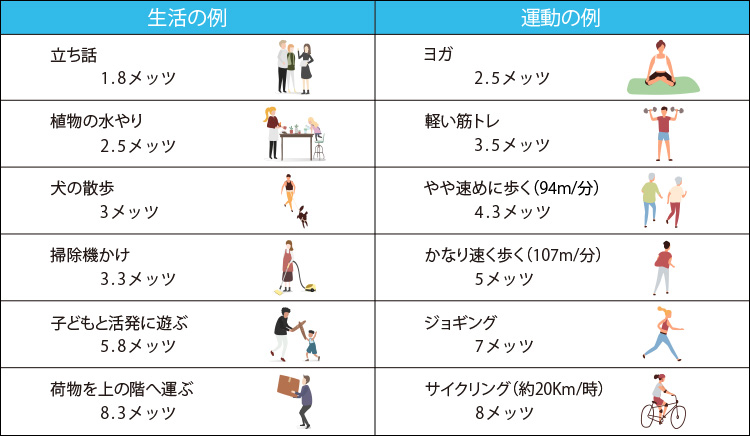
METsを用いることで消費カロリー計算が可能。酸素を1リットルの消費は、5kcalのエネルギーを消費することになるため、1METの運動を1時間行うと、だいたい体重1kgあたり3.5(ml/kg/分)×60(分/h)×5(kcal/リットル)÷1000=1.05kcalのエネルギーを消費することになる。
【消費エネルギーを求める簡易換算式】
消費エネルギー量(kcal)=体重(kg)×METs数(mL/kg/min)×運動時間(h)×1.05(kcal/METs/kg/h)
例) 散歩=3METsの運動を体重60kgの人が1時間行った場合の消費カロリー
3(METs) × 1(時間) × 60(kg) ×1.05= 189(kcal)
注)より正確に身体活動による消費カロリーを計算したい場合は、体重や運動の強度だけでなく、性別、年齢なども考慮した式を用いる。
糖尿病薬物療法
糖尿病経口治療薬ビッグ3
→メトホルミン、SGLT2阻害薬、DPP-4阻害薬
4番手で追加するなら
→αGI、グリニド系(シュアポスト)、 もしくは少量SU剤(グリクラジド)
×チアゾリジン系は心不全禁忌、膀胱癌↑、女性で骨折増加のため高齢者医療には不向き
×イメグリミンはメトホルミンとの併用できない、腎不全で使用できない時点で出番なし
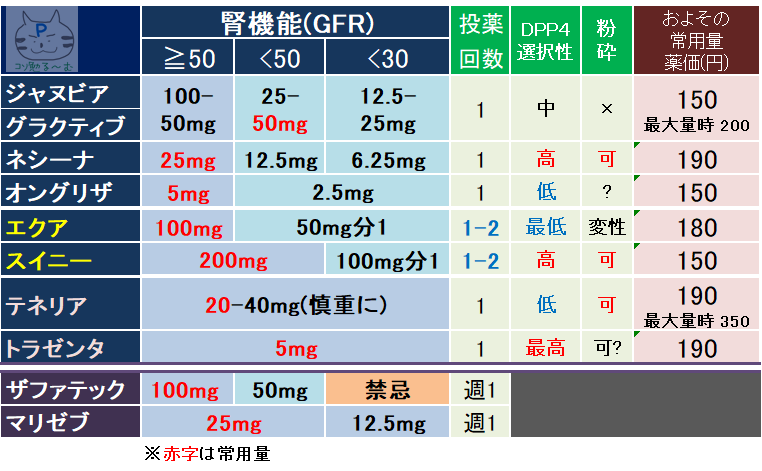
CKDで投与を避ける薬(eGFRが30mL/分/1.73m2未満)
→ビグアナイド薬、SU薬、チアゾリジン薬、グリニド薬
心不全で投与を避ける薬
→ビグアナイド薬、チアゾリジン薬は禁忌
低血糖の原因薬剤として最多なのはSU剤(インスリンではない)
※SU薬は必ず一包化からは外し、食事が半分未満しか取れない場合は、低血糖になる危険性が高いため内服しないようにしてくださいと、ご家族にもよく説明しておく。
初診の糖尿病患者にまず行うべき検査
空腹時血中CPRが0.5~0.6ng/mL未満の場合
→インスリン依存状態と判断し、インスリン治療が必要
※すでにインスリン導入中患者のインスリン中止の可否判断にも使用できる
- 1型糖尿病の除外
- 膵臓関連自己抗体:高GAD抗体、抗島高中性脂肪血症愛(ICA)、抗インスリン自己抗体、抗I A2抗体/ICA512抗体
- インスリン分泌能の評価
- 尿中CPR(24時間畜尿)
- 空腹時血中CPR
糖尿病患者ではインスリン分泌能の指標となり、24時間尿中CPRが20μg/日以下、または空腹時血中CPRが0.5~0.6ng/mL以下であれば、インスリン分泌が高度に低下した状態(インスリン依存状態)と考えられ、インスリン治療が必要とされる - CPI:CPI=血中CPR÷血糖値×100
正常値:1.60±0.57(早朝空腹時に測定する)
CPI <0.8でインスリン療法を考慮する
CPIが0.8〜1.2の場合は、GLP-1受容体作動薬が有用な場合もある
CPIが1.2以上の場合は食事・経口薬治療を選択できる
※CPRは、腎機能が低下している場合には見かけ上高値に出ることがあり、鵜呑みにできない - HOMA-β
(空腹時インスリン値(μU/mL)x360) ÷ (空腹時血糖値(mg/dL)-63)
にて計算され、インスリン分泌能の指標。
Homeostatic Model Assessment of beta cell functionの略
30%以下の場合、インスリン基礎分泌低下がある(日本人の場合は正常でも50%程度で欧米人は100%) - インスリン追加分泌能の指標:insulinogenic index
追加分泌能の指標となるがOGTT試験が必要でめんどう
- インスリン抵抗性の評価
- HOMA-IR = 空腹時血糖値(mg/dl) × 空腹時インスリン値(µU/ml) / 405
正常が1.6以下で、 2.5以上を抵抗性ありと判断。
また、早朝空腹時血中インスリン値≧15μU/mLのとき抵抗性ありと判断。
Homeostatic Model Assessment for Insulin Resistanceの略で、インスリン抵抗性の指標のひとつとして用いられる。
- HOMA-IR = 空腹時血糖値(mg/dl) × 空腹時インスリン値(µU/ml) / 405
血中インスリン値は注射製剤の影響を受けるため、内因性のインスリン分泌能評価にはCPRが有用である。
さらにインスリン抗体陽性の患者ではインスリンが正しく測定できない。
CPRはインスリンと1:1の比率で合成・分泌される。
腎機能低下例ではCPR尿中排泄が減少し血中CPRが高値となるため、評価に注意が必要。
- f-CPI(空腹時CPI)とpp-CPI(食後CPI)は良好な相関を示す(R=0.5)が完全には一致しない
- f-CPI:基礎分泌の指標→再現性は高いだろう
- pp-CPI:追加分泌の指標→食事内容やタイミングにより変化が大きいだろう
- pp-CPI<5程度がインスリンが必要となる目安
- インスリン依存性の指標としてpp-CPIが最も有用という報告もある
- インスリン療法
- 絶対適応:1型糖尿病,糖尿病昏睡・ケトアシドーシス,重症の肝障害 ・ 腎障害・感染症,妊娠(妊娠計画期・妊娠中・授乳期)
- 相対適応:高血糖による症状,著明な高血糖(約 300 mg / dl 以上),尿ケトン体陽性,経口血糖降下薬で血糖コントロールが不十分(HbA1c ≧ 9.0%)
- 日本人では追加分泌が障害されやすく、超速効型の食後3回打ちがよい→超速効型インスリン毎食直前3回注射により食後高血糖を抑制することで心血管イベントが有意に減少したというデータがある
- インスリン療法を行っている場合はSMBG、isCGMが保険適応となった
- インスリンの長期保存は冷蔵庫、使用開始後は常温保管でよい
- 1型糖尿病、またはインスリン依存状態では1日必要量は0.7単位/㎏で、そのうち半量を持効型溶解インスリンとして、残り半量を毎食前の超速効型インスリンとする
- 製剤の種類:
- ◎超速効型:食直前投与でOK(ノボラピッドは効果発現まで10~20分)、作用発現時間はフィアスプ=ルムジェブ>ノボラピッド=ヒューマログ=アスパルトBS、たくさん種類がある。フィアスプ、ルムジェブは超超即効型とも言われ、健常者のインスリン分泌により近く、ノボラピッドより5~10分早いため、食直前投与(0~2分前)が可能(ノボラピッドの至適投与時間は食前15~20分)。フィアスプ、ルムジェブでは食事量が安定しない患者でも食事開始後20分で投与しても食前同様の血糖降下作用を示した。
- ×速効型:作用発現まで30分、効果最大1~3時間、効果持続5~8時間→食後の低血糖が生じやすい、2種類しかない
- ×中間型:2種類しかない
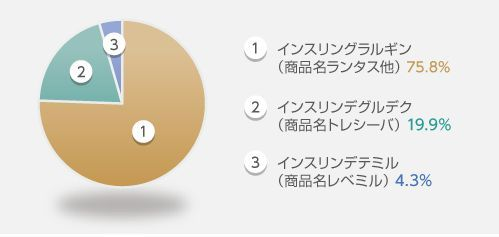
- ◎持効型溶解:ランタス、レべミル、トレシーバ、だいたい作用時間24時間だが、ランタスXRは24時間以上効果が持続する
ランタスは安く作用時間が24時間のため、自己注射のケースを中心に頻用されている
デグルデク(2013年~)は作用持続時間42時間超と最長で最大作用時間に明らかなピークがなく平坦で安定しており、毎回決まった時間に投与せずともよい→±8時間程度の投与時刻調整が融通可能で要介護状態の患者に対する代理注射などで使用しやすい
- △基礎インスリン/短時間作用型GLP-1受容体作動薬配合剤
- IDegLira(インスリンデグルデク/リラグルチド):商品名ゾルトファイ、ノボノルディスク、2019年
持効型Basal インスリン製剤であるインスリンデグルデクと GLP-1受容体作動薬であるリラグルチドとの固定比率配合注である
より肥満度が高くインスリン必要量が高い人に適応
ゾルトファイの最大のメリットは、トレシーバとビクトーザをそれぞれ単独で処方するよりも、薬剤費が、約4割 安くなる点。 インスリン強化療法や、BOT療法の基礎インスリンを、ゾルトファイに変更すると、体重増加を抑制しつつ、血糖コントロールを改善できる可能性がある。デメリットはGLP-1の投与量が希望通りとならないこと→ダメじゃん! - IGlarLixi(インスリングラルギン/リキシセチナチド):商品名ソリクア、サノフィ、2019年
肥満度が軽いケースに使用する
- IDegLira(インスリンデグルデク/リラグルチド):商品名ゾルトファイ、ノボノルディスク、2019年
インスリンアナログ(「インスリンに似たもの」の意味をもつ)製剤はインスリンと同じ生理作用を持ちながら、体内におけるインスリンの作用持続時間などを調節したもので、超速効型(作用発現時間が10〜20分で作用持続時間が3〜5時間)や持効型(作用持続時間が約24時間又はそれ以上)などがある。
ヒトインスリン製剤は微生物によってヒト型のインスリンを産生させ精製などを行い製剤化したもので、速効型(作用発現時間が30〜1時間で作用持続時間が5〜8時間)、中間型(作用持続時間は18〜24時間〔同じ中間型でも製剤によって作用時間に開きがある〕)などがある。
経口薬投与無効→BOT 療法(Basal supported Oral Therapy:経口薬を継続したまま基礎インスリンを補充する併用療法)→強化インスリン療法へステップアップする
強化インスリン療法では体重増加と低血糖、患者のコンプライアンスの問題がある
→基礎インスリン/短時間作用型GLP-1受容体作動薬配合剤も選択肢のひとつ
①インスリン分泌を促進することなく血糖を改善する薬剤
- ビグアナイド薬(BG):メトグルコ(メトホルミン)1錠10円
- 新規投与の際には1回250mg、1日2回から開始→750~1500mgで維持
- 肝臓からの糖新生を抑える、消化管からの糖の吸収を抑える、筋肉などでのインスリンの働きを強める
- 用量依存性に作用増強(日本での最大投与量2250㎎=9錠/日)、臨床試験で1500㎎まで血糖降下作用を認めた
- GLP-1分泌促進作用もある→欧米では肥満合併糖尿病の第一選択薬
- 禁忌が多い!心肺肝腎の障害(EGFR<30など)、脱水、大量飲酒、75歳以上の人には新規処方を避ける(乳酸アシドーシスのリスク←1万人に1人程度の発症率だが致死的)
- eGFR30~45では慎重投与
- 造影剤検査時、乳酸アシドーシスを避けるために、検査の2日前から造影剤投与後2日間の合計5日間まで休薬する
- 副作用は食欲不振、悪心・嘔吐、下痢などの消化器症状と乳酸アシドーシス
- インスリン分泌を促進しないため、体重増加を助長しにくいので第一選択
- チアゾリジン薬(TZD):アクトス(ピオグリタゾン)
- チアゾリジン薬による代謝の改善は,①脂肪の再分布,②脂肪細胞の質の変化およびそれに伴うインスリンシグナルの改善,③慢性炎症の改善という3つの機序によって説明されている
- ①脂肪の再分布:
- チアゾリジン薬は,皮下脂肪中心に脂肪組織への脂肪酸取り込みを増加させる.また,脂肪組織において中性脂肪分解による脂肪酸放出を抑制し,その結果2次的に骨格筋や肝臓への脂肪酸の取り込みが減少→中性脂肪蓄積に起因したインスリン抵抗性が改善する.骨格筋や肝臓から皮下脂肪への脂肪の再分布は,fatty acid steal仮説と呼ばれる
- ②脂肪細胞の質的変化およびそれに伴うインスリンシグナルの改善:
- 大きな脂肪細胞をアポトーシスさせ小さな脂肪細胞を増加させることでアディポサイトカインを改善→インスリン抵抗性を改善
- ③慢性炎症の改善
- 適応:肥満合併でインスリン抵抗性がある人、空腹時血中インスリン10μU/mL以上、HOMA-IR2.5以上など
- 日本では,ピオグリタゾン(アクトス®)のみ使用可
- 日本でピオグリタゾンとメトホルミンの合剤(メタクト®)が発売された
- Na再吸収→浮腫(8-10%)、心不全の増悪あり、心不全既往患者には投与禁忌!利尿剤併用も有効。
- 膀胱癌との関連が報告されており、膀胱癌治療患者には投与しない
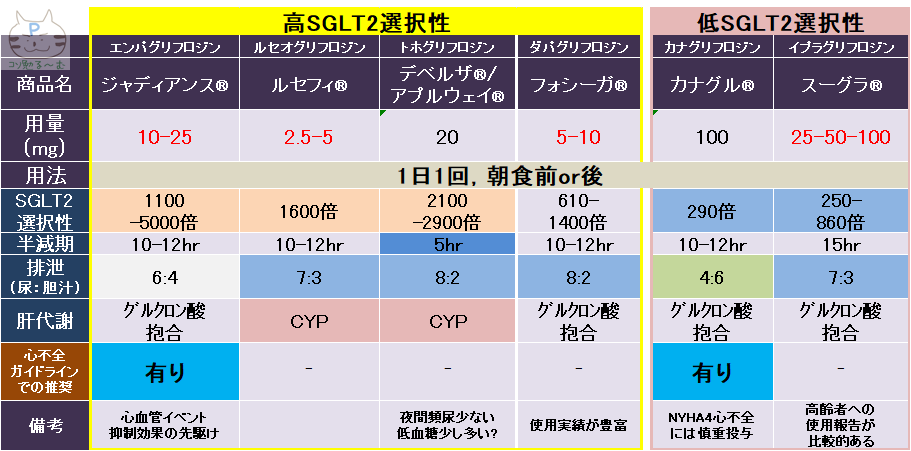
- SGLT2阻害薬
- 心血管イベント抑制効果などは,おそらくclass effect(SGLT2阻害薬であれば,全ての薬剤で同様の有効性が望める)
- 尿路感染症の既往があると尿路感染症発生率が跳ね上がる(通常1%未満→16%)
- 尿要路感染症発症時は中止せざるを得ない
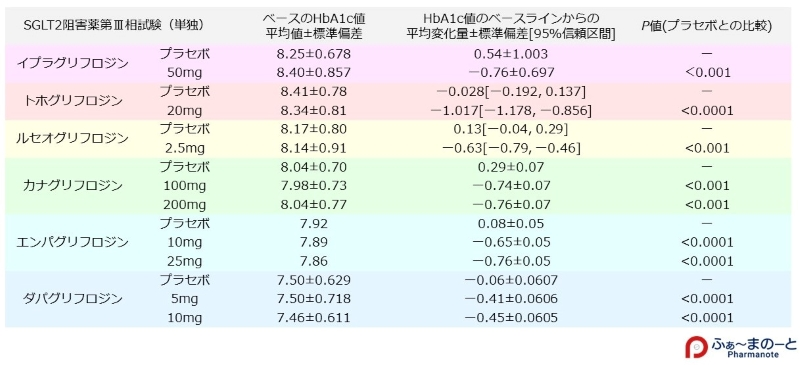
- 血糖降下作用はジャディアンス25㎎=カナグル100㎎>フォシーガ(直接比較ではない)
- 心血管疾患の既往、心不全、微量アルブミン尿・蛋白尿を有する場合は積極的に投与開始する
- ガイドラインでの推奨:
- 急性・慢性心不全ガイドライン2021
- すべてのHFrEF(心不全標準治療がすでに行われている)にジャディアンスとフォシーガの使用が推奨
- 心不全を合併した糖尿病に対する治療に、エンパグリフロジン,カナグリフロジン,ダパグリフロジンが推奨
- 急性・慢性心不全ガイドライン2021
- 心不全の適応:フォシーガ、ジャディアンス
- 腎不全の適応:フォシーガのみ(カナグルはDM合併のCKDのみ適応)
- ガイドラインでの推奨:
- 〇ジャディアンス(エンパグリフロジン)
- エビデンス:
心血管疾患既往の2型糖尿病患者で、SGLT2阻害薬「ジャディアンス」の標準治療への上乗せにより、プラセボと比較して、初回および再発の心血管イベントリスクが低下する
▼3P-MACE 22%減少、▼心不全による入院 42%減少、▼全ての原因による入院 17%減少、▼致死的・非致死的心筋梗塞(一般に心臓発作と呼ばれる) 21%減少、▼冠動脈疾患イベント(心筋梗塞と冠動脈血行再建術の複合) 20%減少。 - ジャディアンス増量の際は10㎎→20㎎ではなく、10㎎→25㎎への増量
- エビデンス:
- ◎フォシーガ(ダパグリフロジン)
- エビデンス:
DAPA-CKD試験では、ダパグリフロジンは、腎機能の悪化もしくは心血管死または腎不全による死亡(eGFRの50%以上の持続的低下、末期腎不全への進行、心血管死、腎不全による死亡)による主要複合評価項目を、プラセボと比べて39%低下させたことが示されている(中央値2.4年の試験で絶対リスク減少[ARR]=5.3% p値<0.0001)。この結果は、2型糖尿病合併の有無に関わらず一貫していた。
- エビデンス:
- △カナグル
- エビデンス:
- 血糖降下作用:単剤でHbA1cで-0.76%の減少効果
- 用法用量が決まっており増量ができない
- 腎機能低下患者では、糸球体濾過率が低下しているため血糖降下作用が減弱する
- 老年症候群(サルコペニア、認知機能低下、ADL 低下など)のある場合には慎重に投与する→サルコペニアが進行する
- 浸透圧利尿により尿量が増加し、多尿・頻尿がみられる→脱水に注意が必要
- DAPA-CKD試験において、SGLT2阻害薬は(2型糖尿病の有無を問わず)腎保護作用を有していることが示され、フォシーガは慢性腎不全、慢性心不全に保険適応拡大
- SGLT2阻害剤はDPP-4阻害薬、メトホルミンに次いで第3位の糖尿病治療薬処方量
- 血糖降下以外に体重減少(内臓脂肪減少)、血圧低下、TG低下、HDL-C増加、尿酸低下なども期待できる
- インスリン作用不足が高度の時には危険な副作用(正常血糖ケトアシドーシス)などの可能性もあり、重症の場合の糖毒性解除はインスリンが安全で確実
- 腎不全合併例では、ACEI/ARB同様、投与直後よりeGFR低下を認める(30%までの低下であれば中~長期的には腎保護作用が期待できる)
- DM性網膜症の予防効果も指摘されている
SGLT2阻害薬の作用機序である尿中グルコース排泄促進作用により、脂肪酸代謝が亢進しケトーシスがあらわれ、ケトアシドーシスに至ると考えられている。通常、糖尿病ケトアシドーシスは高血糖になるが、SGLT2阻害薬を服用している場合は高血糖でなくともケトアシドーシス(悪心・嘔吐、倦怠感、口渇、食欲低下などで発症)があらわれることがあるため、気づくことが遅れてしまう可能性がある。
- α-グルコシダーゼ阻害薬(α-GI)
- 必ず食直前に服用する。
- αグルコシダーゼ阻害薬による血糖降下作用は、HbA1cにして約0.7%
- 目的は食後高血糖の改善であり、血糖降下作用はあまり強くない
- 血糖降下以外の+α作用は証明されていない
- グルコバイ
- ベイスン
- △セイブル(ミグリトール)
- 処方できる条件に制約がある(SU剤、ビグアニド、インスリンと併用)ため使用しづらい
グルコースを排泄することからエネルギーバランスが負になるため、脂肪組織(なかでも内臓脂肪)の分解が進み体重が減少します。脂肪が分解されればケトン体が出てきますが、糖尿病が進行してインスリン分泌能がかなり低下しているような患者では、ケトン体が蓄積しやすくなります。また、肥満者であればまず脂肪組織が分解されますが、痩せていて脂肪組織が少ない患者では、エネルギー枯渇状態になると筋肉を分解して糖新生を亢進させようとします。筋肉の少ない高齢者では、さらなる筋肉の減少によって転倒・骨折やADLの低下といったリスクが増大します。これらを踏まえると、比較的若く腎機能が保たれた肥満の2型糖尿病者が、よい適応とされています。
- Journal of Diabetes Investigation(IF3.6)、中国からのメタアナリシス
非アルコール性脂肪性肝疾患(NAFLD)を罹患している2型糖尿病患者において、SGLT2阻害薬はALTと肝脂肪を大幅に減少させ、体重減少を伴う→サンプルサイズも少なく今後のRCTによる検証が必要
②血糖依存性にインスリン分泌を促進する薬剤
- DPP4阻害薬:インクレチン関連薬、GLP-1分解酵素のDPP4阻害
- 高齢者を中心に頻用されるが、心血管イベント抑制に関するエビデンスは乏しい(+αがない)
- 肥満の患者への有効性は乏しい→非肥満患者に良い適応(GLP-1作動薬と逆)
- 腎障害による容量調節が必要(禁忌ではなく、減量によりCKDでも使用可能)
- とくに高齢者(65 歳以上)、軽度腎機能低下(Cr1.0mg/dl 以上)、あるいは両者が併存する場合には、DPP-4阻害薬追加の際に以下のように SU 薬の減量を必須とする
アマリール(グリメピリド)2mg/日を超えて使用している患者⇒2mg 以下に減量
オイグルコン、ダオニール(グリベンクラミド)1.25mg/日を超えて使用している患者⇒1.25mg/日以下に減量
グリミクロン(グリクラジド)40mg/日を超えて使用している患者⇒40mg/日以下に減量 - もともと SU 薬が上記の量以下で治療されていて、血糖コントロールが不十分な場合はそのまま投与の上併用し、血糖の改善がみられれば、必要に応じて SU 薬を減量する。
- SU 薬をベースとした治療に併用する際、SU 薬の投与量について判断しがたい場合、あるいは SU 薬と DPP-4阻害薬を含む 3 剤以上の併用療法を行おうとする場合は専門医へのコンサルトを強く推奨する。
- 急性膵炎の合併症あり、心不全増悪するものもある
- 水泡性類天疱瘡の発症が報告されている
- DPP-4阻害薬の特徴:エクアとスイニー以外1日1回投与、合剤がいろいろでている
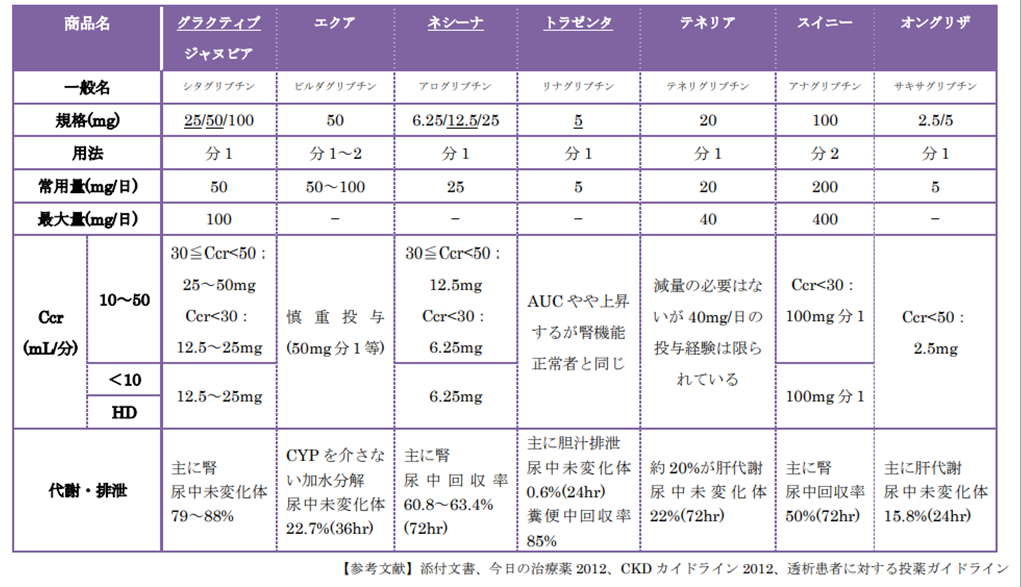
- ◎グラクティブ/ジャヌビア:売上No1
- 値段も規格も完全一致、ファーストインクラス、最安価、合剤はスージャヌ(SGLT2阻害)
- エクア:
- 肝代謝>腎代謝(肝障害で禁忌)、1日2回、合剤はエクメット(BG)
- ◎トラゼンタ:売上2位
- 腎障害でも減量不要、透析患者でも使用できるが血糖降下作用はいまいち、増量ができない
- ネシーナ:
- 臨床試験データでは25mg12週間投与→HbA1c-0.77%
- 増量できない、合剤はイニシンク(BG)とリオベル(チアゾリジン)
- in vitroでDPP-4高選択性が示されているがin vivoでの影響は???
- テネリア:売上No3
- 自社データではDDP-4阻害薬中最強を謳っている
- DPP-4阻害薬同士からの切り替え(テネリア20㎎)でHbA1c改善効果(実測値で-0.4%低下)が示された
- 40㎎でも効果が20㎎の2倍になるわけではない
- 腎機能用量調節不要で増量効果(20mg→40mg)もあり、CKD症例や高齢症例で単剤コントロールを目指したい場合は最適の薬剤(但し,40%程度は腎排泄なので,増量時は慎重に)
- OD錠がある、合剤はカナリア(SGLT2阻害)
- スイニー:脂質異常改善効果もあるらしい
- オングリザ:とくに推奨なし
- ◎グラクティブ/ジャヌビア:売上No1
- 週1回投与のザファテック、マリゼブもある→服薬アドヒアランス向上を目的に開発
違いは,重度腎機能障害例でザファテック(トレラグリプチン)が禁忌となるのに対して,オマリグリプチンは減量すれば使用可能
リリーホームページより
両剤を併用した際の臨床試験成績はなく、有効性及び安全性は確認されておりませんので、低血糖や胃腸障害を含む副作用の発現に十分ご注意ください。
日本糖尿病学会による『糖尿病治療ガイド2020-2021』
「DPP-4阻害薬とGLP-1受容体作動薬との併用は行わない」と記載されている
両薬の併用は保険診療では現状認められておらず、現時点ではレセプトで査定される
DPP-4阻害薬については、1型糖尿病の適応がないのも注意
Intestine Secretion Insulin から命名された、消化管ホルモンの一種。
インクレチンは、食事による栄養素の刺激を受けることで消化管から分泌されるホルモンの総称で、膵臓のβ細胞に作用してインスリンの分泌を促す。
GIP:グルコース依存性インスリン分泌刺激ホルモン glucose-dependent insulinotropic polypeptide
主に十二指腸や上部空腸から分泌される
薬理学的濃度にすると強力な食欲抑制効果が示された→マンジャロの開発
GLP-1:グルカゴン様ペプチド 1 glucagon-like peptide-1
主に回腸~大腸から分泌される

GIPは当初、脂肪蓄積やグルカゴン上昇などをきたし治療のターゲットにならないと考えられていたが、徐々に高濃度GIPの食欲抑制効果が示され、GIP/GLP-1受容体作動薬(マンジャロ)の開発に至った。
インクレチンには細胞死抑制による膵β細胞保護作用が見られており,ヒト糖尿病においてもインクレチン関連薬が進行性膵 β 細胞量減少を抑制する可能性も示唆されており、今後の長期成績が注目される
同じセマグルチドだが、オゼンピックとは全く異なる残念な結果
GLP-1受容体作動薬は、ペプチド構造で分子量が4000程度と大きいため、胃からの吸収が難しく、さらに消化酵素によりすぐに分解されてしまうため経口薬の創薬は困難と考えられていた。サルカプロザートナトリウム(SNAC)と呼ばれる吸収促進剤を添加することで、SNACと経口セマグルチド(GLP-1受容体作動薬)の複合体が、ペプシンにより分解されにくくなり胃からの吸収が促進され、経口で十分な効果を発揮できるように開発された。経口セマグルチドは一日一回経口投与、つまり口から飲むだけでいいという、他の注射薬とは一線を画す特徴を持った薬だが、吸収率を安定させるため早朝空腹時に服用し、服用後30分間は飲食できないという制限がある。
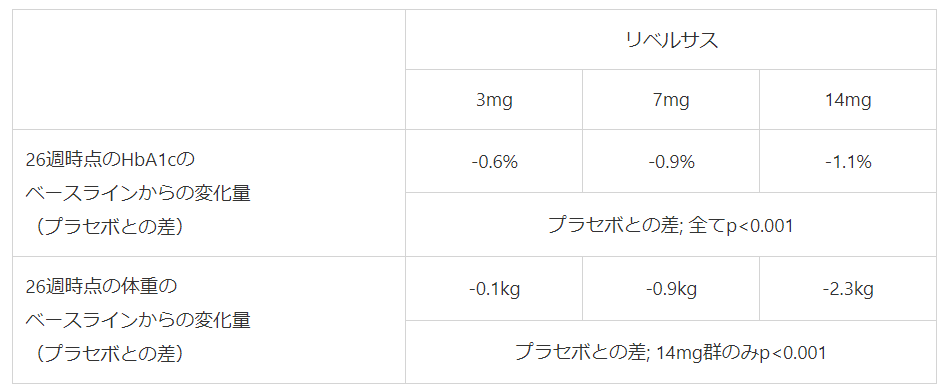
3mg 139.60円
7mg 325.70円
14mg 488.50円 1か月14,655円(トルリシティ2,807×4=11,228円)
リベルサス
圧倒的パワー不足の臨床試験成績
https://passmed.co.jp/di/archives/579
- GLP-1受容体作動薬→アナログ製剤のためDPP-4で分解されない!!!
- DPP-4阻害薬に比し圧倒的な血糖改善作用(トラゼンタはHbA1c-0.4%、GLP-1作動薬は)
- GLP-1作動薬とDPP-4阻害薬の併用は意味がないし(GLP-1作動薬はアナログ製剤)保険で査定される
- 血糖降下作用以外にもさまざまな生理活性作用を有する
- 心血管疾患2次予防効果も証明されている
- 心血管イベントを有意に抑制するエビデンスがあるのは3つ
- 週1回製剤のデュラグルチド(トルリシティ)←高齢者向き
- 週1回製剤のセマグルチド(オゼンピック)←若年肥満者向き
- 1日1回製剤のリラグルチド(ビクトーザ)
- CKD増悪抑制効果も証明されている
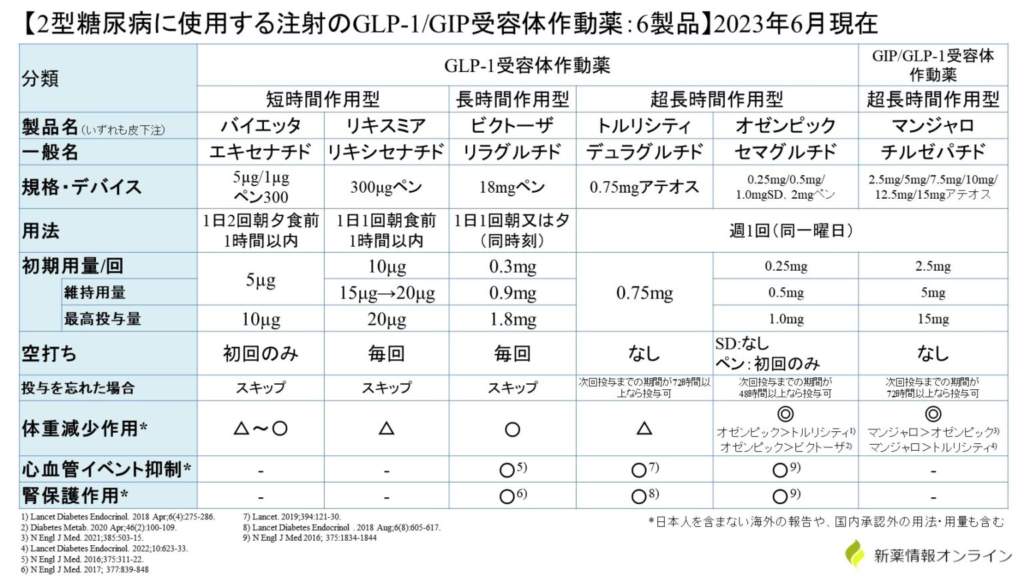
- 日本には5種類の薬がある(注射4種類、内服1種類)
- ビクトーザ(リラグルチド):糖尿病治療薬として開発、2010年6月国内発売
- サクセンダ(リラグルチド):肥満症治療薬として開発されたが国内未承認、FDAで認可されている抗肥満薬(BMI30以上、もしくはBMI27以上で肥満に関連する疾患がある方)、92%で減量効果あり(1/3で10%以上の体重減少)
- ◎オゼンピック(セマグルチド):0.5mg2752円、1.0mg5504円、週1回投与、ノボ
- 臨床試験データ:HbA1c変化量は0.5mgで-1.56%、1mgで-1.73%
- GLP-1作動薬の中で体重減効果が最も大きい(がマンジャロに負けた)
- ウゴービ注(セマグルチド)は肥満症治療薬だが高血圧または糖尿病の合併が必要条件
- 〇リベルサス(セマグルチド):糖尿病治療薬、唯一の内服製剤、1日1回経口投与、2021年2月日本発売
- ※リベルサスは服薬アドヒアランスが重要→早朝空腹時に120mLの水で服用し30分は絶飲食
→元気だけど注射が嫌いな人によい、認知症や高齢者では使用困難 - リベルサスとオゼンピックの成分であるセマグルチドと他のGLP-1の成分を比較した研究では、セマグルチド注の体重減少は他のGLP-1成分と比べ約3倍であった
- セマグルチド注を68週間、週1回投与したグループでは1人あたり平均14.9%体重が減少した(NEJM,2021)、12-18歳の若年肥満者でも68週時の10%以上の体重減少率が62%と有効性が証明された(NEJM,2022,11)
- ※リベルサスは服薬アドヒアランスが重要→早朝空腹時に120mLの水で服用し30分は絶飲食
- リキスミア(リキシセナチド):1日1回皮下注、胃内容物排泄抑制効果大
- ◎トルリシティ(デュラグルチド):0.75㎎=2807円、イーライリリー
- 臨床試験データ:HbA1c変化量-1.35%
- 痩せた高齢者向き、週1回投与製剤、体重減少効果は少なく空腹時血糖降下作用大、HBA1c低下作用強
- 心血管イベント抑制作用、腎保護作用
- マンジャロと同一デバイス、1回使い切り製剤=アテオス(当てて押す!)
- 副作用→悪心:8%、便秘:11%、食欲減退:4%、下痢:11%、嘔吐:1%
- 短時間作用型(エキセナチド、リキセナチド):
おもに胃内用排出遅延作用やグルカゴン分泌抑制作用を介して血糖改善効果を発揮するため、患者の膵β細胞機能の影響を受けにくい - 長時間作用型(リラグルチド、徐放型エキセナチド製剤、デュラグルチド、セマグルチド):
おもにインスリン分泌促進及びグルカゴン分泌抑制を介して血糖改善効果を発揮するため、患者の膵β細胞機能の影響を受けやすい
リラグルチドは1日1回製剤だが長時間作用型に分類されているようだ。その他は週1回製剤。
- GIP/GLP-1受容体作動薬→1種類のみ、2022年9月承認
- チルゼパニド(マンジャロ):田辺三菱/イーライリリー
- (週1回製剤なのに)もっとも強力な体重減少効果が認められるため、肥満を伴う若年型糖尿病がよい適応(非肥満者や高齢者ではフレイルやサルコペニアが起きうる)
- 体重減少効果は用量依存性に減少する
マンジャロ5mg:-5.8kg 5mg=3848円
マンジャロ10mg:-8.5kg 10mg=5772円
マンジャロ15mg:-10.7kg 15mg=11544円
対象薬トルリシティ0.75mg:-0.5kg - もっとも強力な血糖降下作用=臨床試験ではHbA1cを実測値で-2~3%低下させる、9割以上の方が合併症予防の目標であるHbA1c:7.0以下を達成(対象薬のトルリシティ0.75mg(常用量):-1.3%)
- 投与方法:2.5㎎から投与開始し、4週後に5㎎まで増量、5㎎=3800円、1か月で16000円、週1回製剤
- 副作用→悪心12~20%、便秘:14~18%、食欲減退:13~22%、下痢:9~17%、嘔吐:5~12%
- チルゼパニド(マンジャロ):田辺三菱/イーライリリー

- ◎ミトコンドリア機能改善薬:イメグリミン(ツイミーグ)2021年 34円
- 2023年11月現在、爆発的に売れすぎて出荷調整中
- イメグリミンは、ミトコンドリアを介して、グルコース濃度依存的にインスリン分泌を促す「膵作用」と、肝臓・骨格筋での糖代謝を改善してインスリン抵抗性を改善する「膵外作用」という異なる2つの作用によって血糖を低下させる
- eGFR 45mL/分/1.73m2未満の腎障害患者への投与は推奨されていない
- メトホルミンとの併用も避ける
- グルコース濃度依存的なインスリン分泌促進+肝・筋での糖代謝改善作用
- 作用機序に関する分子メカニズムの詳細は不明らしい→よく承認したなー
- 現状ではエビデンスに乏しく今後の臨床データを待つ方がよい
- 低血糖に注意必要
- 小児、妊婦への投与禁
③血糖非依存性にインスリン分泌を促進する薬剤
SU剤とグリニド系薬
臨床現場で頻用されるSU剤は
グリベンクラミド(ダオニール、オイグルコン)
グリクラジド(グリミクロン)
グリメピリド(アマリール)
グリメピリド(アマリール)1mg<グリクラジド(グリミクロン)40mg<グリベンクラミド2.5mg
グリニド系薬剤
ナテグリニド(ファスティックとスターシス)、ミチグリニド(グルファスト)、レパグリニド(シュアポスト)
残念ながら、いずれの薬剤も血糖低下作用は弱いと言わざるを得ません。
作用機序から理想的な薬物動態と考えられましたが、肝心の効果は弱めな薬剤
- スルホニル尿素(SU)薬:
- 腎不全では使用できない
- SU薬とグリニド薬の併用はNG(ともに膵臓のベータ細胞からのインスリン分泌促進薬)
- SU薬は持効型インスリンとして用いる→食後高血糖治療にはSU剤増量ではなく併用療法がよい
- 心血管イベント抑制効果に関するエビデンスはない
- SU剤の種類と特徴:コスパ最強の血糖降下薬、必ず少量から開始する
- ×××オイグルコン(グリベンクラミド):
- 血糖降下作用が強すぎるため、もはや使用してはならない
- 長時間作用型で1日1~2回でよい反面、遷延性低血糖のリスクも大きく使用頻度は減少傾向
- ◎グリミクロン(グリクラジド):
- 血糖降下作用以外に抗酸化作用、血小板機能亢進抑制作用がある、SU剤併用時の低血糖頻度が最少、CVD発症、死亡率の改善が期待できる
- 通常成人では1日40mgより開始し、1日1〜2回(朝または朝夕)食前または食後に経口投与する
- 維持量は通常1日40〜最大80mgまで
- 10㎎分1あさから開始すればよい(夜間低血糖を避けるため)らしい
- アマリール(グリメピリド):
- 第3世代SU剤、作用時間、インスリン分泌促進作用は弱いが生体内では血糖低下作用はグリベンクラミドと同等とされる→筋肉、脂肪細胞の末梢組織や肝臓での膵外作用が血糖降下作用を強めるとされる
- 薬価が程々で発売3年でSU薬のトップシェアに躍り出た薬
- メリット:安価(1か月分で300~450円)
- 実臨床では、1日1回 朝食前後に0.5mgから使用開始、最大2㎎まで
- ×××オイグルコン(グリベンクラミド):
- グリニド薬はより効果が速く現れ、また短時間で効果がなくなる→食直前に服用し食後高血糖を改善する
- グルコース非依存性にインスリン分泌を亢進するので低血糖が起こりやすい
- SU薬とグリニド系薬との併用は無意味だが、他のどの経口血糖降下薬とも併用可能(※GLP-1受容体作動薬とSU剤併用時には注意事項が多数あるので保険上の縛りや添付文書を確認する!)
- 第一世代SU剤は虚血性心疾患が増加するという研究結果があったが第2世代以降は明らかな因果関係はない
- SU剤を内服して食事制限や運動しないと当然太る
- グリニド系
- 効果発現時間が短く短時間のインスリン分泌作用(3-4時間)を持ち、食後高血糖治療に用いる(SU剤との最大の相違点)
- 血糖降下作用はSU剤>>グリニド系→軽度の食後高血糖がよい適応
- αGI同様、コンプライアンスに難あり(毎食直前に内服、施設系なら使用しやすいか)
- どちらかというとSU剤というよりもαGIに似た治療効果(=食後高血糖の改善)
- グリニド系は食直前内服が基本(食後では効果減弱、食前30分では低血糖リスクあり)
- グリニド系の種類と特徴
- ◎レパグリニド(シュアポスト®錠0.25mg/0.5mg錠・3錠/3日):2011年発売(最新)
- 血糖降下作用最強で作用時間1hr(最短)、持続時間5-8時間(最長)
- 食事・運動療法か、食事・運動療法とα-GI併用で効果不十分の2型糖尿病が適応
- 腎不全にも使用可能(慎重投与)
- 重度肝機能障害のある患者には低用量(1回0.125mg)から投与を開始する
- 1回0.25mgより開始し、1日3回毎食直前に経口投与
- スターシス/ファスティック(ナテグリニド):成分は同じ、透析患者には禁忌
- グルファスト(ミチグリニド):2004年発売、スターシス/ファスティックより強力
- グルベス配合錠:ミチグリニドカルシウム10mgとボグリボース0.2mgとの配合剤で、α-GIにより食後の糖吸収を穏やかにし、立ち上がりの遅いインスリンをグリニドで改善。食前内服。
- ◎レパグリニド(シュアポスト®錠0.25mg/0.5mg錠・3錠/3日):2011年発売(最新)
①、②、または①+②では低血糖をきたすことはないが③は単剤でも低血糖を起こし併用ではさらに高頻度となる
目標を達成できない、低血糖、体重増加などの場合にはDM専門医にコンサルトする
高齢者糖尿病
エンドオブライフの状態では、著しい高血糖を防止し、それに伴う脱水や急性合併症を予防する治療を優先する
- 糖尿病リソースガイド「2型糖尿病の薬物療法のアルゴリズム」
- 高齢者糖尿病診療ガイドライン2023
- DASC-8評価表にてカテゴリー分け、それぞれ管理目標が異なる
Iは健常者、IIはフレイル相当、IIIは要介護相当と考えてもよい
SU剤使用中は血糖管理目標が緩く設定されている - 訪問服薬指導などもアドヒアランス向上に有用である(インスリンや週1回製剤など)
- 運動、社会活動、デイサービスなどの利用を促す→認知機能の維持、うつの改善、寝たきり防止
- 高齢者糖尿病ではフレイル、サルコペニアを合併しやすく死亡率も急上昇する
- 運動+栄養指導(タンパク質摂取1.0~1.5g/㎏実体重)セットではじめて筋肉量を維持できる
- メトホルミンやチアゾリジン系は筋力低下を抑制するが、高齢者では肝腎機能低下例も多く要注意
- SGLT2阻害薬は体重減少、筋力低下の危険がある
- GLP-1作動薬による体重減少、消化器症状(悪心嘔吐、下痢)にも注意が必要
- メトホルミン→定期的に肝機能、腎機能評価が必要(腎不全に禁忌、乳酸アシドーシスリスク↑)、メトホルミンが、がんの発症リスクを低減している可能性がある。2型糖尿病患者でのがんの発症率は、メトホルミン使用者で低かったという報告がある。
- チアゾリジン→女性の骨盤骨折リスク↑、心不全リスク↑、最近は処方頻度が激減しているらしい
- SGLT2阻害薬→脱水、尿路/性器感染、低栄養、サルコペニアのリスク↑
1型糖尿病
病初期における1型と2型の違いは基礎分泌が保たれているかどうか
- 疫学
- 1型糖尿病の全年齢の患者数は約 10~14 万人(世界では840万人)
- 日本においては糖尿病患者100人に1人の割合
- 診断
- 抗GAD抗体
- GAD=glutamic acid decarboxylase=グルタミン酸脱炭酸酵素
- 1型糖尿病発症時の陽性率は40~70%
- 罹病期間の短い(5年以内)患者の陽性率は40~60%
- 罹病期間の長い(5年以上)患者の陽性率は30~50%
- 年齢を問わない(小児、成人とも陽性率は同等)
- 抗IA-2抗体
- IA-2=insulinoma-associated antigen-2=インスリノーマ関連蛋白
- 1型糖尿病発症時や罹病期間の短い患者の陽性率は50~60%
- 発症年齢が高くなると陽性率が低下(成人では発症時でも約20%)
- 罹病期間が5年以上になると、成人でも小児でも陽性率は20~30%
- IAA
- IAA=insulin autoantibody=インスリン自己抗体
- 1型糖尿病発症時の陽性率は約20%
- ICA→保険適応外
- ICA=islet cell antibody=膵島細胞抗体
- 1型糖尿病発症時の陽性率はほぼ100%
- 経過とともに陽性率は低下し、10年後には陽性率約10%
- ZnT8抗体→保険適応外
- ZnT8=zinc transporter 8=亜鉛輸送担体8
- 2007年に新たに同定 上記4抗体陰性者の26%で陽性
- 抗GAD抗体
実臨床では・・・
抗GAD抗体と抗IA-2抗体には相関がないため、両方測定することにより1型糖尿病の診断率は高まる
ただし両者を同時に測定することは保険では認められておらず、まず抗GAD抗体を測定し、陰性ならIA-2抗体を測定することになっている
2型糖尿病患者での抗GAD抗体陽性率は3~14%という報告がある
抗GAD抗体の抗体価が高値の場合には、経過中に緩徐進行1型糖尿病を発症する可能性が高い
1型糖尿病を強く疑っている場合には、抗GAD抗体+IAAをまず測定し陰性なら抗IA-2抗体も測定する
- IDDM薬物療法:
- 1型糖尿病に対して適応があるSGLT2阻害薬
- スーグラ(イプラグリフロジン)
- フォシーガ(ダパグリフロジン)
- 1型糖尿病に対して適応があるSGLT2阻害薬
脂質異常症
- 動脈硬化性疾患予防ガイドライン2023(日本動脈硬化学会)
- 主な改定点
- 高TG血症:随時採血で175mg/dL以上で脂質異常と診断
→随時の値のほうがむしろ心血管イベントを予測する力が強いという報告による。国内データでも随時 TG 167 mg/dL 以上でTG 84 mg/dL 未満と比べ冠動脈疾患が 2.86 倍,心筋梗塞は 3.14 倍,狭心症は 2.67 倍,突然死は 3.37 倍上昇する。
- 高TG血症:随時採血で175mg/dL以上で脂質異常と診断
- 主な改定点
- 久山町スコア:日本人の動脈硬化性心血管疾患の10年リスクを予測する新しいスコア
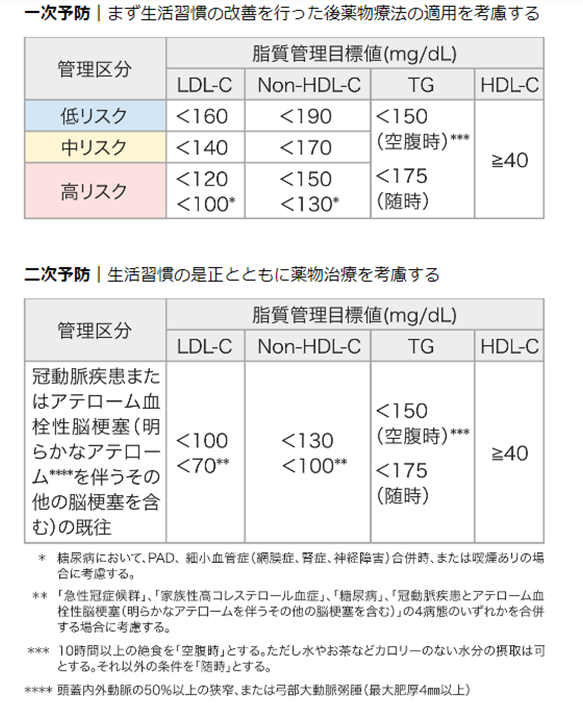
動脈硬化性心血管疾患=冠動脈疾患+アテローム血栓性脳梗塞の両方を対象とした研究である - 二次予防:ステップ1→3の二次予防管理目標へ
- 最高リスクではLDL<70目標
- 一次予防:ステップ1→2のリスク分類→3の一次予防管理目標へ
- 3-6か月の非薬物療法で改善がない場合に薬物療法を考慮する(LDL>180は薬物療法の即時導入)
- リスク別に応じた管理目標値がある(最高リスクではLDL<100)
- 一般的に高リスク群(=10年間CVD発症率10%以上)に該当する場合にはすぐに薬物療法を考慮する

ステップ1

ステップ2:動脈硬化リスクのスコアリング
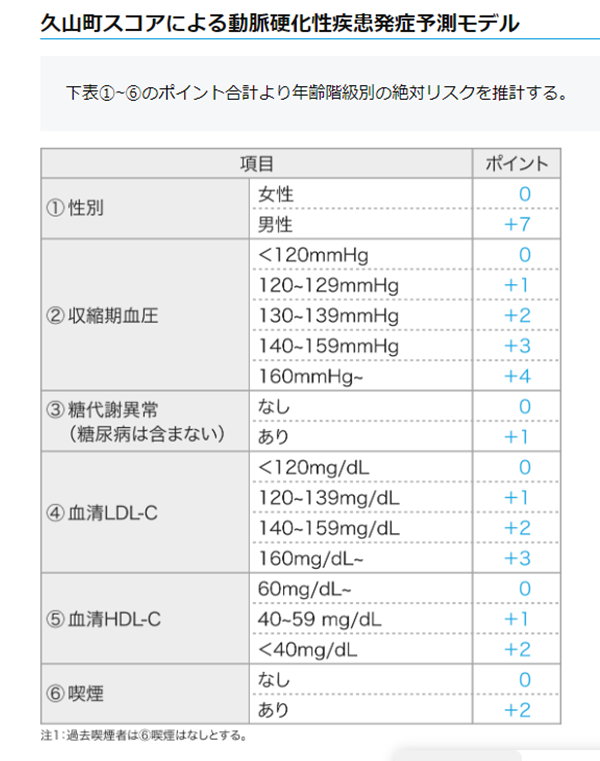
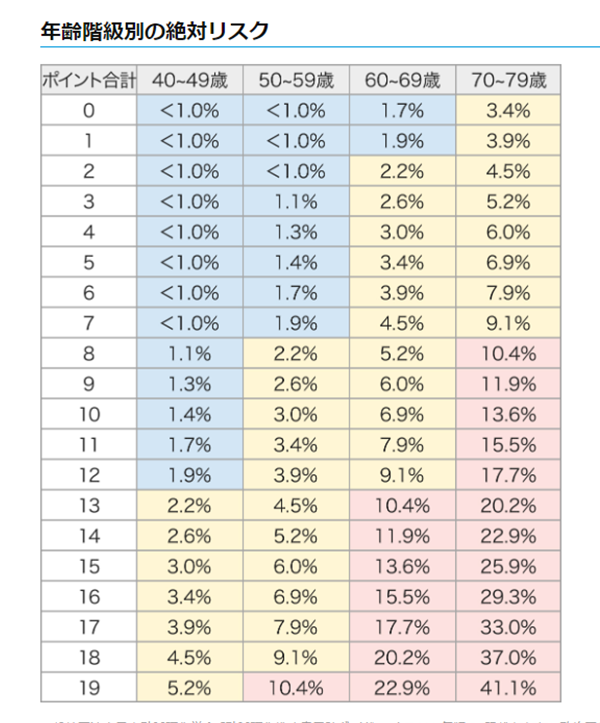
ステップ3:リスク分類に基づく管理目標
- 薬物療法
- スタチン系
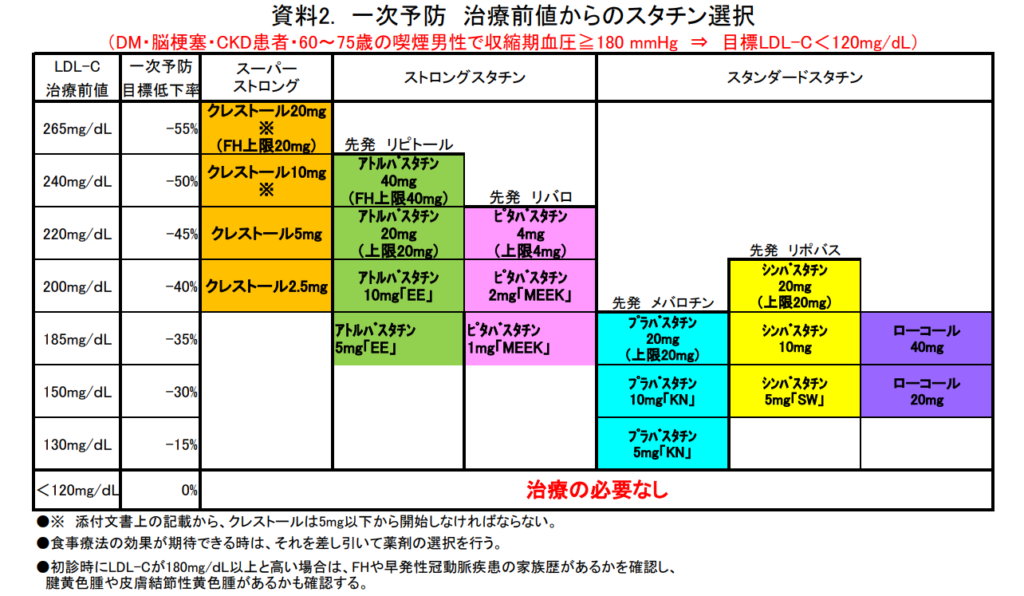
- 治療前値によって選択薬がほぼ決まってくる
- 2型糖尿病患者へのスタチン投与により冠動脈疾患死亡リスク、心血管疾患発症リスク、脳梗塞発症リスクを有意に低下させる
- 筋症状は約4人に1人程度、内服開始1年以内、ストロングスタチン>スタンダードスタチンに多い
- ミオパチー0.01%(1万分の1)、横紋筋融解症0.002%(5万分の1)→自覚症状だけで判断できずCKで評価するしかない
- 血清ビタミンD値が低いと筋肉痛やミオパチーの頻度が増加する
- ストロングスタチンでも目標値達成できない場合は併用療法を考慮する→上乗せによる心血管イベント抑制効果があるものは2種類のみ
- エゼミチブ(ゼチーア、小腸コレステロールトランスポーター阻害剤):実臨床では現状これ一択しかない
- エボロクマブ(レパーサ、PCSK-9阻害薬):処方に制約(施設要件)があり、薬価が24000円/2週、注射剤のみ
- スタチン系
- 高TG血症治療薬→3択しかない
- フィブラート系
- フィブラート系によるCVD抑制効果は大規模臨床試験で証明されていない
- 2型糖尿病患者に対するフィブラート系薬剤の長期投与により非致死性心筋梗塞発症の抑制を認めた
→主要項目の冠動脈疾患イベント発症は減少しなかった、治療意義はあるのか? - 横紋筋融解症のリスクあり→発症しやすい因子としては、高齢、腎機能低下や糖尿病、甲状腺機能低下の合併
- スタチンとフィブラート系薬剤を併用では、スタチン単独よりも横紋筋融解症の発症は3~5倍に増加する
- 腎機能低下例では用量調節が必要
- 肝機能障害の副作用あり
- パルモディア(ペマフィブラート):
- 世界初の選択的PPARαモジュレーター(SPPARMα)として2018年6月に日本で発売
- 高TG血症および低HDL-C血症に対する治療薬
- 代謝経路は肝胆汁排泄のため腎機能低下例にも減量不要
- 肝障害やCre上昇などのフィブラート系特有の有害事象が少ない
- ペマフィブラートのCVイベント抑制効果を実証する大規模臨床試験であるPROMINENT試験が進行中
- ニコチン酸誘導体
- オメガ 3 脂肪酸(EPA製剤):
- 「エパデール®」「ロトリガ®」
- フィブラート系
血管年齢のスクリーニング
PWV
CAVI
ABI
高尿酸血症
- ガイドライン:高尿酸血症・痛風の治療ガイドライン2019(日本痛風核酸代謝学会)
- 高尿酸血症の定義と罹患率:血漿中尿酸値7.0㎎/dL以上、有病率は男性全人口の20%、女性全人口の5%(2010年)
- 尿酸の生成:食品のプリン体からの尿酸は全体の 20%に過ぎず、残りの 80%は細胞(遺伝子)の代謝やエネルギー代謝による
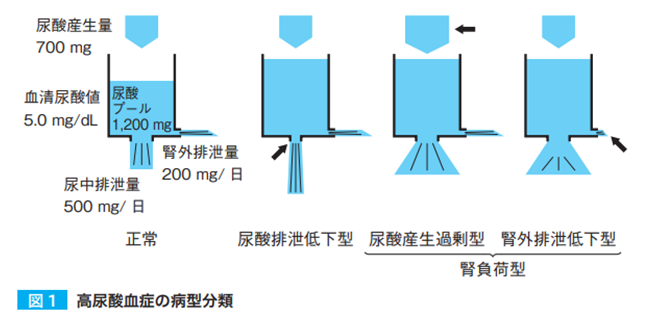
- 病型分類:血清尿酸値は尿酸の産生量と腎・腸管での排泄量とのバランスにより規定されている。体内尿酸プールは1200㎎で、1日の尿酸摂取量が700~800㎎でほぼ同量が排泄(2/3は腎臓から排泄されるが、糸球体濾過量の90%程度は尿細管で再吸収されている)されている。尿酸排泄低下型60%、腎負荷型10%(尿酸産生過剰型と腎外排泄低下型)、両者の混合型30%に分類される。
- 近年、尿酸再吸収率の亢進が影響していることが分かった→選択的尿酸再吸収阻害薬(SURI:ユリス)が開発された(2020年発売)。インスリン抵抗性(メタボと高尿酸血症は併存しやすい)が尿酸再吸収を亢進させているというデータもある。
- 高尿酸血症の合併症:
- 痛風腎:30%に合併する
- 腎結石・尿管結石:20%以上に合併し、尿が酸性化し析出しやすい。シュウ酸Ca結石、尿酸結石ともに増加
- 痛風関節炎:通常は一度に 1 ヶ所だけ。発作は 1~2 週間で治まる
- 高血圧:血清尿酸値は将来における高血圧発症の独立した予測因子とされる
- 脳梗塞:脳卒中の初発ならびに再発リスク,心不全による予後ならびに再入院の予測因子となる可能性がある
- 心血管イベント(?):高尿酸血症が独立した心血管リスクというコンセンサスは得られていないが、2022年のJAMAに掲載された論文では、心血管疾患のリスクは痛風発作後0~60日で1.89倍、61~120日で1.64倍と報告されているJAMA(2022; 328: 440-450)
- コントロール目標:
- 無症候性高尿酸血症に対する薬物療法を直接的に支持する明確なエビデンスはない(生命予後や心血管イベントの改善に寄与しないため、積極的な治療対象とはしないのが一般的、それ以上に優先すべきことがあるはず→禁煙や節酒、減量など)
- 尿酸値<6.0mg/dL→全身の尿酸結晶が溶け出し合併症が減るとされる
- 痛風結節を有する場合には<5.0mg/dLを目標とするという意見もある(コンセンサスはない)
- 高尿酸血症の治療:原則は食事療法+飲酒制限+運動療法
- 利尿剤で脱水→痛風発作→NSAIDSでAKI発症ということもある
- プリン体(プリン塩基)の多い食事を避ける(発泡酒>ビール、レバー、白子、小魚、甲殻類、干しシイタケ、鰹節)
- スジコやイクラ、数の子などの魚卵はそんなにプリン体多くない
- 9.0㎎/dL以上は明らかに痛風ハイリスク→尿酸降下薬投与が推奨される(8.0㎎/dL台は生活習慣の改善を試す)
- 果糖(フルクトース)の摂取はアルコール摂取に匹敵するほど、痛風発作の誘発因子
- 高尿酸血症の患者を診たらその他の生活習慣病の併発がないかチェックする
- 腎不全の合併がないか、腎機能をチェックする必要がある
- 尿酸排泄促進薬は尿中尿酸排泄が低下している場合に用い、尿酸生成亢進型に用いると尿酸結石を生じるリスクが高まる
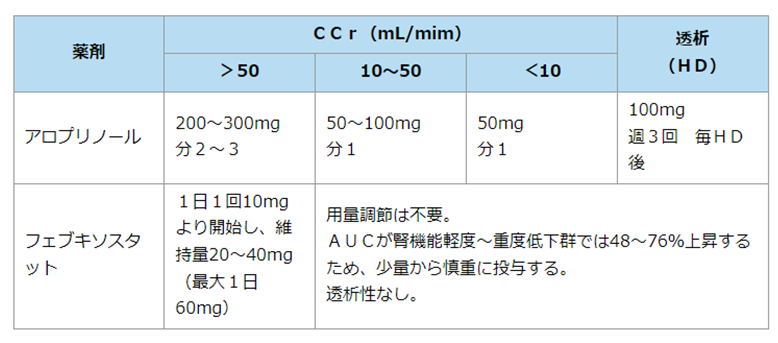
- 尿酸産生阻害薬は腎不全の場合には第一選択、中等度以上の腎障害例ではアロプリノールは用量を調節する必要があるが、非プリンアナログ系産生阻害薬は中等度までの腎障害例では用量調節が不要である

- 選択的尿酸再吸収阻害薬(SURI)
- ユリス(ドチヌラド)
- 尿中尿酸排泄亢進→尿量維持しないと尿管結石増加する(特に投与初期)
- 重度の腎機能障害患者(eGFRが30mL/min/1.73m2未満)には投与しない
- 尿酸値低下作用は最強のフェブキソスタットと同等であった(有害事象率も同等)
- ユリス(ドチヌラド)
- 尿酸生成抑制薬→腎機能低下症例の第一選択(特にフェブリクが推奨)
- アロプリノール(アロプリノール錠、ザイロリック)
- 腎障害患者に使用する場合は、腎障害の程度に合わせて投与量を調節が必要だが基本は投与避ける
→肝障害、血球減少、TEN、SSSSなどの報告がある - 1日3回飲む必要あり、安いくすり46.2円/日
- プリン骨格を持つため、他の核酸代謝酵素にも影響を与えやすい
- アジア人で重症薬疹が多いとされる
- 処方上の注意
- 用法:200~300mg/日 分2~3
- ワーファリンとの相互作用あり
- 腎障害患者に使用する場合は、腎障害の程度に合わせて投与量を調節が必要だが基本は投与避ける
- トピロキソスタット(トピロリック)→不要
- 肝代謝のため、腎障害による減量が不要
- 慢性腎臓病を対象にした臨床試験の結果、尿酸値低下作用に加えて、尿中アルブミン量を低下させる
- 重大な副作用が多い:皮膚粘膜眼症候群、中毒性表皮壊死症、薬剤性間質性腎炎
- 尿酸低下作用はフェブリクに劣る
- 1日2回服用
- 痛風関節炎の発現率がアロプリノールよりやや高め
- ◎フェブキソスタット(フェブリク)→尿酸値低下作用が最強
- 高尿酸血症の「尿酸産生過剰型」「尿酸排泄低下型」のいずれのタイプに対しても有効
- アロプリノールよりも強力に尿酸値を低下させる
- 肝代謝のため、腎障害による減量が不要
- 副作用は下痢やめまいなど
- がん化学療法に伴う高尿酸血症にも保険適応がある
- 1日1回でよい(アロプリノールは分3)が薬価はアロプリノールの2倍と高い
- メルカプトプリン水和物またはアザチオプリンとは相互併用禁忌
- アロプリノールに比べて総死亡と心血管イベントが有意に増加したRCTがある(NEJM2018:ハザード比1.22-1.34)
- アロプリノール(アロプリノール錠、ザイロリック)
- 尿酸排泄促進薬
- プロベネシド、ブコローム(パラミヂン)、ベンズブロマロンがあり、ベンズブロマロン使用頻度が最多
- ベンズブロマロンで劇症肝炎が報告された
- ARBのロサルタン(ニューロタン)に尿酸排泄促進による尿酸値低下作用が証明された
- 尿酸排泄促進薬は、尿路結石予防のための尿量管理を行う必要がある(尿のアルカリ化と1日尿量2L以上)
- 尿のアルカリ化としてウラリット配合錠(または散)と併用する
- その他
- SGLT2阻害薬やGLP-1受容体作動薬に尿酸排泄作用が証明された
- アトルバスタチンにも尿酸低下作用あり
- 降圧剤のシルニジピン(アテレック)にも尿酸値低下作用あり
- ループ利尿薬、サイアザイド系は尿酸値上昇させる
CKDガイドライン2018では、「高尿酸血症を有するCKD患者に対する尿酸低下療法は腎機能悪化を抑制し、尿蛋白を減少させる可能性があり、行うよう提案する(C2)」とされている
最新の論文
①慢性腎臓病の進行リスクの高い群において、アロプリノールによる尿酸低下療法はプラセボと比較して推算糸球体濾過量の低下を抑制しないという結果であった(N Engl J Med 2020; 382:2504-2513)
②1型糖尿尿病を背景とした糖尿病性腎症の方に対する、アロプリノールによる尿酸降下治療は腎機能低下を抑制する効果はなかった(N Engl J Med 2020; 382:2493-2503)
→以上からCKD進展抑制のために尿酸値を積極的に下げる必要はない(だろう)
ループ利尿薬とサイアザイド系はともに尿酸値を上昇させる(用量依存的)。
利尿薬の中でカリウム保持性利尿薬は尿酸代謝への影響が少ないとされている。
β遮断薬、αβ遮断薬は血清尿酸値を上昇させます。
α1遮断薬、ACE阻害薬、そしてCa拮抗薬は尿酸代謝に悪影響を及ぼしません。
ARBは明らかな影響を及ぼしませんが、ARBの一つであるロサルタンカリウムは尿酸トランスポーター(URAT1)を阻害することによって血清尿酸値を平均0.7mg/dl程度低下させる。
痛風
慢性腎不全
CKDに投与が推奨される薬剤
SGLT2阻害薬
利尿薬
→G3(eGFR>30)までは降圧剤としてサイアザイド併用可
G4以上(eGFR<29)は長時間型ループ利尿薬の1択(サイアザイドは腎血流量低下させるため中止)
CCB
→ARB併用可能なら腎血流量を低下させないCCBが推奨
ARB併用不可ならより強力なCCB(アムロジピンorアダラートCR)が推奨
ケースバイケース
ARB/ACEI
→軽症腎不全の進行抑制効果を認める
すでに進展したCKD(G4~5)の場合でも中止によって死亡リスク↑↑となった研究があるため、有害事象(高K血症やeGFR低下)がなければ継続がベター
基本的に中止が推奨される薬剤
PPI
→CKDを進展させる恐れがあるため必要時のみ継続する(抗血小板薬の症例など)
NSAIDS
→腎血流量低下(→糸球体濾過量低下)および尿細管細胞毒性があるので禁忌に近い(とくにボルタレン)
高K血症やAKI、高血圧、浮腫、低Na血症の原因となりうる
eGFR<60では継続投与は避け、eGFR<30では使用しない(KDIGOガイドライン)
COX-2選択的阻害(セレコキシブ)の安全性も検証不十分
最も強力な利尿薬であるループ利尿薬は、腎血流量や糸球体
濾過値を減少させないため腎障害時にも適し、利尿薬の第一選択薬
- メトホルミン:eGFR<30で中止が必須
- SU剤:CCR60未満は慎重投与、CCR30未満は投与禁忌
※透析患者で安心して使えるのはDPP-4阻害薬(トラゼンタ)と一部のGLP-1作動薬(トルリシティ注またはリベルサス)、インスリンのみ - RAS阻害薬:必ずしも中止は不要だが、KやCre上昇には注意し、適宜中止も検討
- SGLT2阻害薬:eGFR<20での新規処方はしないが、継続は可能、透析導入時は中止(無効のため)
- スタチン系:CKDのステージに限らず新規・継続ともに可能(透析導入後は新規処方はしない、継続は可能)
- フィブラート系:ベザフィブラート、フェノフィブラートは用量調節が必要
- アロプリノール:CKDのステージに限らず新規・継続ともに可能だが高尿酸血症治療にCKD進行抑制効果はない
- PPI:メタ解析によってPPIとCKDとの有意な関連性が示され、治療のベネフィットがCKD発症のリスクを上回る場合に処方すべき
- NSAIDS:RAS系と併用するとAKIリスク2倍、PPI+NSAIDSでAKIリスク4倍に増加した報告がある
→NSAIDSによる急性間質性腎炎やAKIは起こりうるのでCKDにはNSAIDS投与しない方がよいが、頻度は1%未満 - リリカ、タリージェ:CCRに応じて減量必要
- サインバルタ:CCR30未満は禁忌
- ベンゾジアゼピン:
- 抗不整脈薬:
総論
- 日本において慢性腎臓病(CKD)患者は約1,330万人存在すると推定。およそ成人の8人に1人が罹患している
- 2021年、日本で初めて「慢性腎臓病」に対する適応を取得したSGLT2阻害剤フォシーガが登場→実際には糖尿病性腎症患者への処方が80%以上
- 微量アルブミン尿が出てeGFRが低下している第2期(早期腎症)の患者にフォシーガを処方する
- 透析導入の主要原因は4割が糖尿病性腎症で、残りの6割は非糖尿病
- タンパク尿が見られる非糖尿病性腎症がフォシーガの良い適応
診断とステージ分類
慢性腎臓病ステージ分類
―腎臓専門医・専門医療機関への紹介基準―
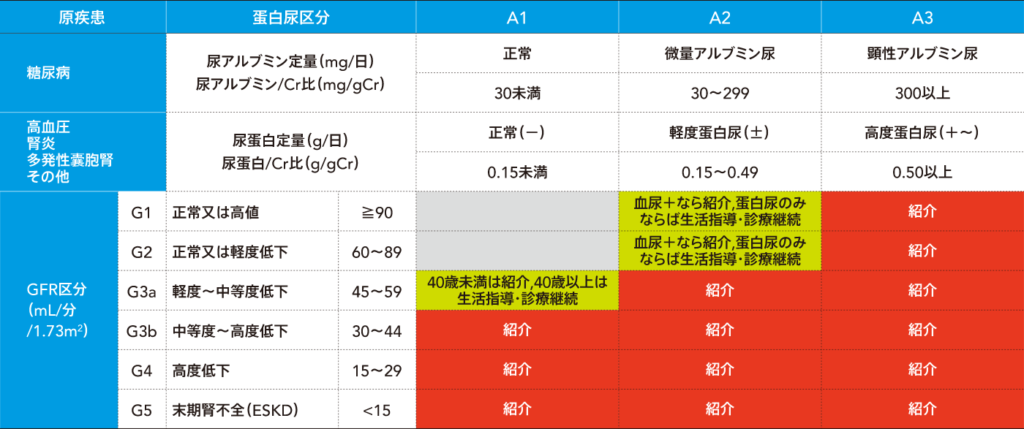
- 尿蛋白検査:
- 定性検査:
- 試験紙法の尿蛋白濃度判定は1+=30mg/dL、2+=100mg/dL、3+=300~500mg/dL、4+=1000mg/dLとおおよそ推定できる
- 試験紙法での蛋白評価は、尿濃縮があれば尿蛋白は過大評価となり、希釈尿であれば過小評価となる
- 定量検査:
- 外来診療では随時尿で尿蛋白量を推定し代用する。1日Cre排泄量を1gと仮定した場合、随時尿の尿蛋白濃度を尿Cre濃度で割った値が1日の尿蛋白量にほぼ等しいとされている。
1日尿蛋白量(g/gCre)=随時尿蛋白濃度÷随時尿Cre濃度
- 外来診療では随時尿で尿蛋白量を推定し代用する。1日Cre排泄量を1gと仮定した場合、随時尿の尿蛋白濃度を尿Cre濃度で割った値が1日の尿蛋白量にほぼ等しいとされている。
- 定性検査:
増悪因子と予後
- 腎機能の増悪因子
- 血圧→血圧管理が不十分であれば、腎機能低下速度は速くなる
- 加齢
- 尿蛋白
- 腎機能低下→腎機能が低下すればするほど、腎機能悪化速度は速くなる
- 予後
- CKDの自然経過では新たな障害が加わらない限り、GFRは経時的にほぼ直線的に低下する→透析導入時期(eGFR<10mL/minとなる地点)を推定できる
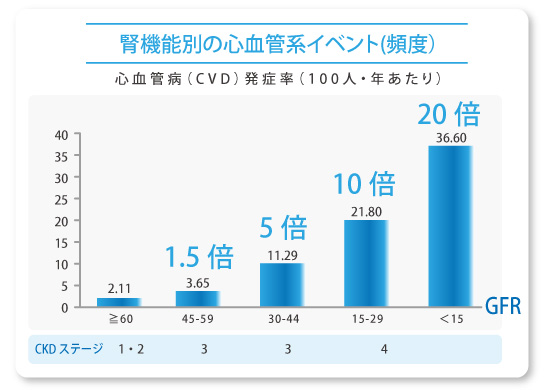
- CKDではCVDによる死亡が多い
- 透析患者の死亡原因の第1位は「心不全」、第2位は「感染症」、第3位もしくは第4位は「脳血管障害(脳卒中<脳出血・ 脳梗塞>)」

管理目標と治療
- CKDの非薬物治療
- 禁酒、禁煙、減量(BMIで22)、減塩(6g未満/日)、血圧コントロール(125/75未満)、運動
- 食事療法
- 蛋白制限はCKD G3a以上で適応となり、標準的には0.6~0.8g/kg×標準体重/日
- 低蛋白療法→腎保護と尿毒症の症状改善に有効
(1)蛋白尿の減少
(2)尿毒症症状の出現遅延
(3)代謝性アシドーシスの改善
(4)リン制限による慢性腎臓病に伴う骨・ミネラル代謝異常の改善 - 塩分制限
- CKDの薬物療法
- 高血圧
まず塩分制限→ACEI/ARB最大量まで→利尿剤の追加→降圧剤の追加(CaIやβB、αB)- G1~3区分のCKD:サイアザイド系利尿薬が推奨される(GFR<20mL/minまで腎機能低下すると単剤での効果は不十分、例:フルイトラン1mgより開始)
- G4~5区分のCKD:ループ利尿薬使用が推奨される(例:ラシックス10mgより開始)
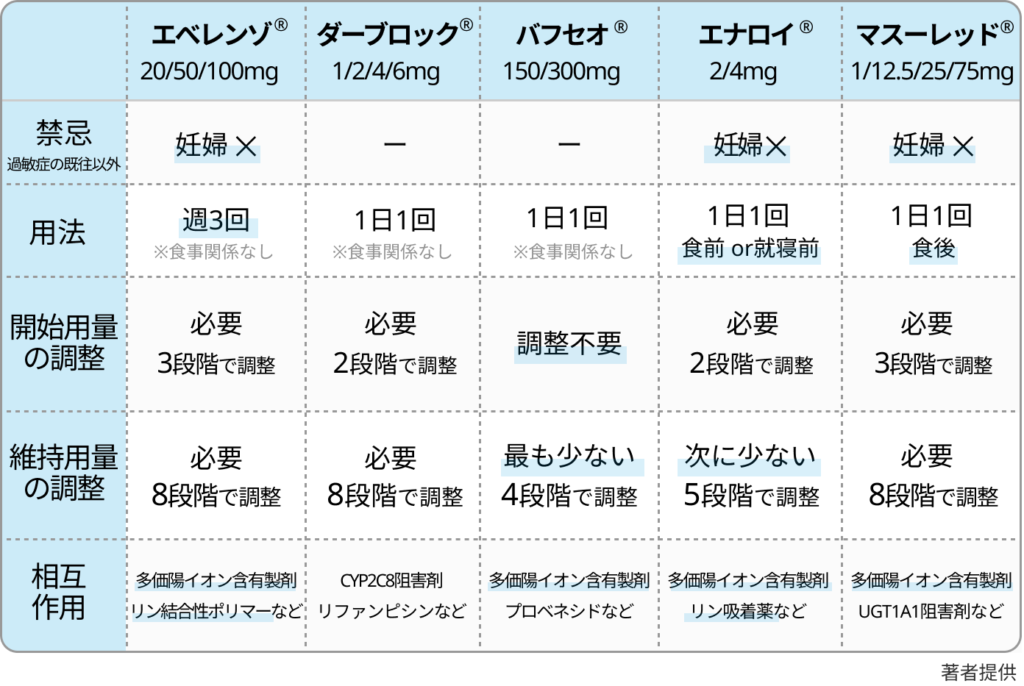
- 腎性貧血
- G3bで35%、G4で60%が腎性貧血→ESA製剤(ダルベポエチンα、ネスプまたはミルセラ)またはHIF-PH阻害薬の開始を検討
- ESA製剤は注射で投与間隔は2~4週間→HIF-PH阻害薬が無難(有害事象も少ない)
- 治療開始はHb10.0g/dL以下(元気な人は<11.0)または有症状例
- Hb13.0以上にはしない、週にHbを0.5を超えて補正しないこと→脳梗塞リスクが上昇する
- ESA製剤
効果持続時間はミルセラ>ネスプだが、後発品のダルベポエチンの使用頻度が高い - HIF-PH阻害薬
低酸素状態における生体内でのEPO産生亢進を強制的に促す内服薬
VEGF↑のため網膜症や悪性腫瘍が増える?とも言われている→投与前、投与中のfollowが必要
鉄を十分に補充し、フェリチン< 100 ng/mLまたはTSAT< 20 %の状態にならないようにする
一部のHIF-PH阻害薬は多価陽イオン含有製剤 (鉄、アルミニウム、Mg、Ca) やリン吸着薬と併用することで血中濃度が大きく減少する- ダプロデュスタット(ダーブロック)
- ◎バダデュスタット(バフセオ):投与方法がもっとも簡単
- エナロデュスタット(エナロイ)
- モリデュスタット(マスーレッド)
- ロキサデュスタット(エベレンゾ)
- 高血圧
- DKDの治療方針
①尿蛋白+のDKDの高血圧では、腎保護作用のRAS阻害薬(ここではACEI=ARB、併用はしない)を可能な限り最大量まで増量する
②それでも尿蛋白コントロール不良の場合→MRAのフィネレノン(ケレンディア)を追加する→尿蛋白減少・腎保護作用
※ケレンディアの適応はRAS阻害薬を最大量投与している2型糖尿病のCKD患者が対象
③シルニジピンはL+N型カルシウム・チャネル阻害薬で、尿蛋白減少効果を有するがケレンディアに比べエビデンスに乏しいので現在はケレンディア>>>シルニジピン - フォローアップの間隔と検査項目
CKD G1(GFR>90mL/min+腎障害):1年ごとに下記のルーチン検査を実施
CKD G2(GFR60~89mL/min):年2~3回、下記のルーチン検査を実施
CKD G3以上(GFR60mL/min未満):一度腎専門医に紹介

- https://medical.nikkeibp.co.jp/leaf/mem/pub/series/maintenance/201411/539515_3.html
急性腎不全(acute renal failure:ARF):血液浄化療法を行う対象であることが前提
急性腎障害(acute kidney injury:AKI):より早期に診断・加療することにより腎不全に至らないようにすることが前提で、現在はAKIを用いる

透析患者にはWF原則禁忌も、有益性上回る場合は考慮
透析患者におけるAfに対するワルファリン治療は安易に行うべきではないものの、ワルファリン治療が有益と判断される場合(一過性脳虚血発作・脳梗塞の既往、左房内血栓の存在、人工弁置換術後、僧帽弁狭窄症合併等)にはPT-INR<2.0に維持することが望ましい(日本透析医学会)
ワルファリンを代表とするビタミンK阻害薬は、石灰化抑制因子の一つであるマトリックスGla蛋白を阻害するため、血管石灰化やカルシフィラキシスの危険因子とされ、透析患者へのワルファリン投与にはジレンマが存在する
腎機能の評価にはGFRと実測CCrがもっとも正確
GFR(糸球体濾過量):尿細管で分泌も再吸収もされないイヌリンクリアランスで計測することがゴールデンスタンダードだが煩雑なためeGFRやC-G式CCrでの代用が一般的(eGFR>eCCrの方がよい)
実測CCr:24時間畜尿し尿中Creと尿量からクリアランス(mL/min)を計算する
Q.では実臨床では?
①eGFR:
単位はmL/min/1.732㎡→体表面積で補正した方がより正確(例1.5㎡ならeGFR×1.5/1.732)
男性 eGFR=194×(年齢)-0.287 ×(SCr)-1.094
女性 eGFR=0.739×194×(年齢)-0.287 ×(SCr)-1.094
2008年に日本腎臓学会が計算式を発表し、現在は腎機能評価にはeGFRを用いることが一般的となった
日本腎臓学会CKDステージ分類もGFR(mL/min/1.732㎡)が使用されている
eGFR計算式の問題点:
血清クレアチニン値に基づく腎機能推算式の中では、eGFRは、標準的な日本人であれば、eCCr(C-G式)よりもより正確に腎機能を推算できる。しかし、痩せた患者、長期臥床患者では推定eCCr(C-G式)以上に腎機能を高く見積もってしまう欠点がある。軽度腎機能障害では正確に腎機能を評価できないが、末期腎不全では問題ない。
②Cockcroft-Gault式:単位はmL/min
eCCr = ((140-年齢(歳))×体重(kg))/(72×血清Cr(mg/dL)(女性の場合:×0.85)
年齢、体重の影響を受ける→体重が2倍になればeCCrも2倍になる(が実際には2倍ということはない)
肥満患者の推算時は患者の理想体重や補正体重を代入する。
クレアチニン自体が尿細管から分泌されるため実際のGFRより30%高く出る→eCCr×0.715程度が実情を反映しているともいえる
★高齢者の腎機能評価:
サルコペニア→筋肉から産生されるクレアチニンが少ないため腎機能低下がマスクされる(血清Cr値が0.6mg/dL未満)ので、本来なら筋肉量の影響を受けないシスタチンCの測定が望ましい
コントロール不良のDM→尿細管からのCre分泌が亢進して、eGFRが高くなる場合がある
★eGFRもeCCRも血清クレアチニン自体が筋肉量によって規定される要素が大きいため、クレアチニンを利用している時点でどうしても体格差や年齢差の影響を排除しきれない(→腎機能の評価にはイヌリンクリアランスがスタンダード)
★シスタチンC値に基づく腎機能推算式(eGFRcys)は血清クレアチニン値に比べ、軽度の腎機能の低下を明確に判断でき、筋肉量や年齢、性別の影響を受けにくい利点があるが、3カ月に1回しか保険で算定できない
高血圧
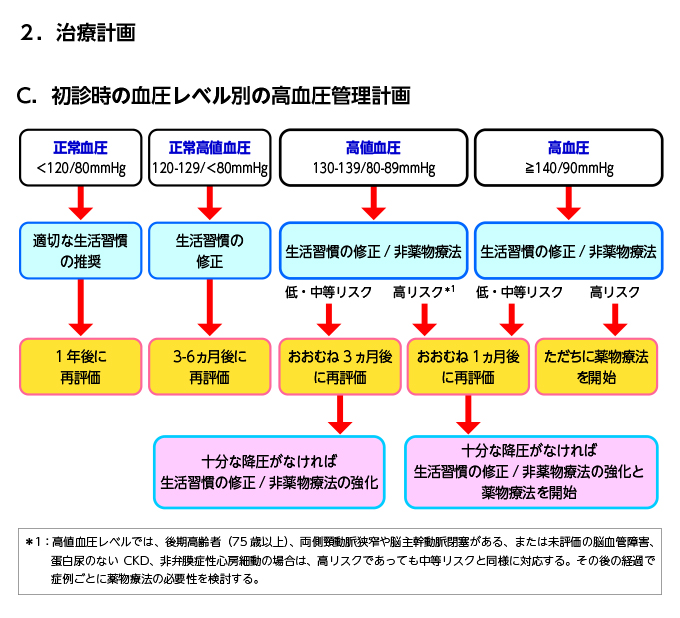
降圧目標は第一段階として診察室血圧140/90(期間は週から月単位で)
クリア出来たら第二段階へすすむか症例ごとに検討
家庭血圧もチェックしてもらう
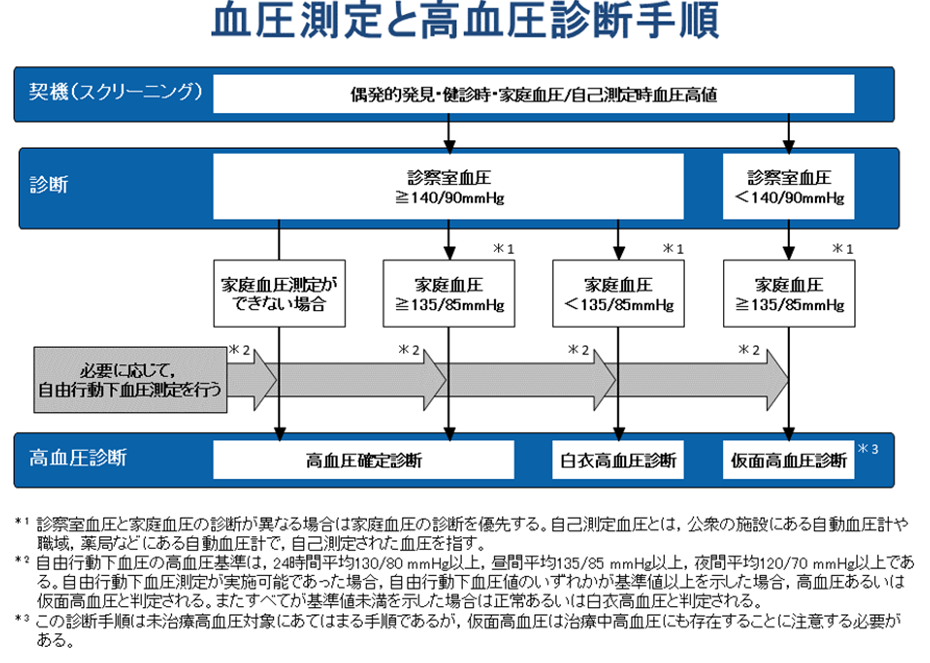



疫学・総論
- 日本の高血圧:4300万人
- 診断および治療には家庭血圧による評価がより重要→血圧手帳をつけてもらう
- 家庭血圧、診察室血圧による判断が困難→自由行動下血圧ABPMによる評価を行う
- JSH2019の高血圧新降圧目標
早朝家庭血圧の降圧目標は~74歳:125/75、75歳~:135/85
~74歳:130/80、75歳~:140/90(DM、脳卒中、心疾患、腎臓病→130/80)
75歳以上の降圧目標も,140/90mmHg未満に引下げられさらに忍容性があれば130/80mmHgを目指す - 2大調節因子は①食塩と②RAA系がシーソーの原理で調整している
- 塩分摂取過剰下ではRAA系が抑制され、ACEI/ARBの降圧効果減弱→利尿剤が効果的
- 高血圧の管理中は検尿による尿蛋白とeGFRの算出が必須(特にCKD合併例)
DM合併CKD→尿中アルブミンと尿中クレアチニンの比(mg/gCre)で評価する
DM非合併→尿蛋白定性±以上の場合、尿蛋白/クレアチニン比(g/gCre)>1.5で尿蛋白陽性と診断する - 血圧は夏場は下がりやすい(-10mmHg程度)
- 治療抵抗性高血圧→3剤併用しても降圧目標以上→高血圧の鑑別が必要
- 腎血管性高血圧にARB投与禁忌→腎血流減少して腎不全が増悪する
- ACEI/ARBは妊娠中は禁忌である
治療
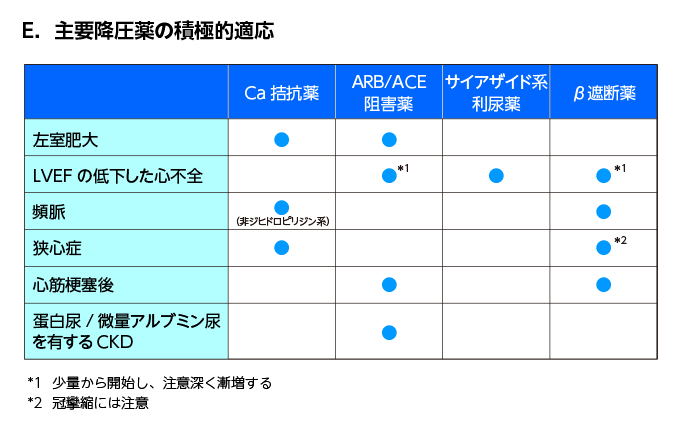
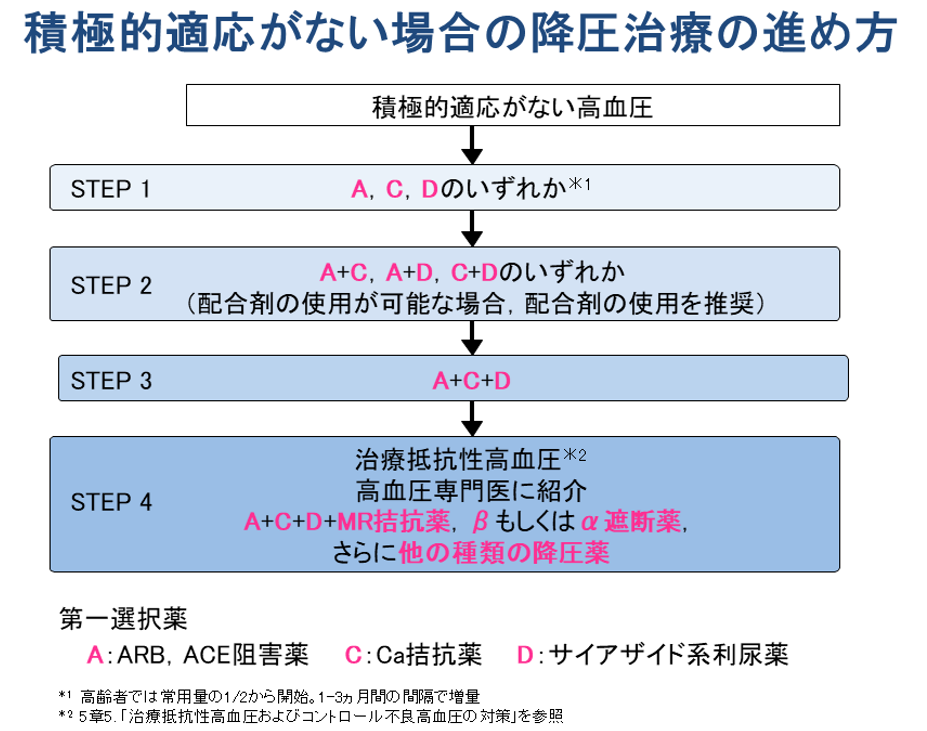
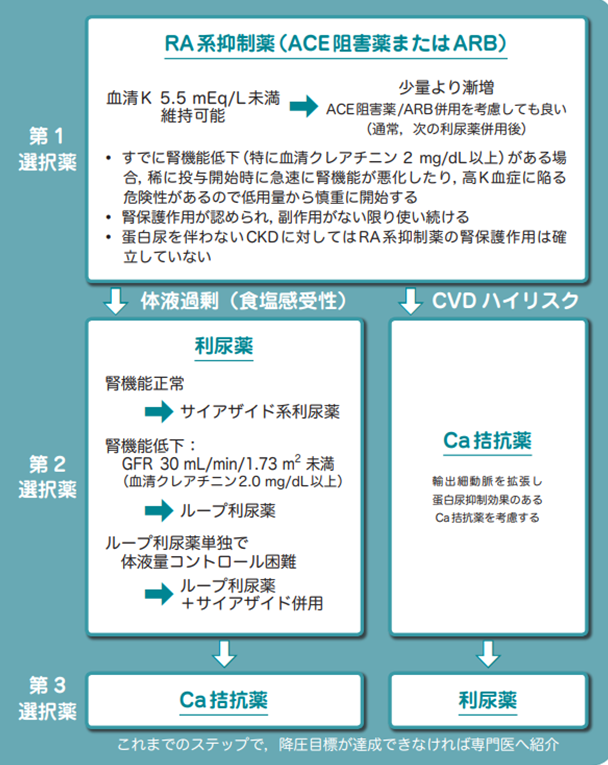
- 積極的適応が優先され、禁忌や慎重投与、有害事象などを考慮して3系統の基本的降圧薬から決定する
- 積極的適応なし→ACEI/ARB、チアジド系、CaIから選択する、どの降圧剤でも予後同じ
- I度高血圧→1剤(少量)で開始
- II/III度高血圧、I度高血圧高リスク→1剤(通常量)または2剤併用(少量)で開始
- 2剤併用の組合わせはACEI/ARB+CaI、ACEI/ARB+チアジド系、CaI+チアジド系が望ましい
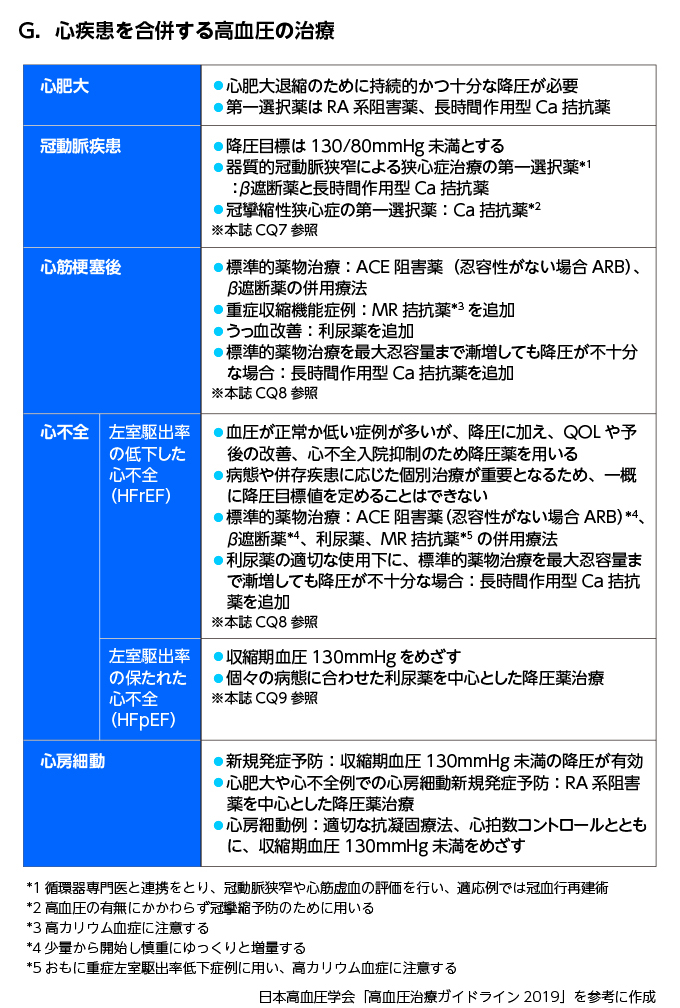
- 積極的適応あり
- HT+DM→ACEIまたはARBが第一選択(心血管イベントを減らす可能性、臓器保護作用)
- OMI+HT→ACEI+βB+MRAが予後改善効果ある
- (労作性)狭心症→狭心症に適応のあるCaIを選択する(ほとんど適応あるが、カルブロック、アテレックはない)
- VSA→第一選択はコニール(ベニジピン)の夕1回投与の一択のみ(エビデンスあり)、低血圧+頻脈ならヘルベッサー(ジルチアゼム)、高血圧ならアダラートCR(ニフェジピン)、早朝に発作が出やすいためニフェジピンCRの夕食後内服が効果的
- HFrEF→ACEI+βB+利尿剤が標準的薬物療法、+MRAでさらに予後改善効果あり
- HFpEF→推奨される降圧剤はない
- 心房細動→RA系阻害薬+抗凝固+レートコントロール(HTは心房細動の増悪因子)
- CKD合併→第一選択はACEI/ARB、体液過剰があれば利尿剤(チアジド系and/orループ)を併用する、さらなる降圧にはCCB(←腎保護作用のあるN型・T型を選択、コニール、ランデル、カルブロック、アテレックなど)腎保護CCB1種類で降圧不十分ならL型(アムロジンなど)を追加してもよい
高K血症の増悪(K<5.5が管理目標)、腎機能悪化に注意が必要 - 血液透析中の患者→収縮期血圧160mmHg前後の予後が最も良い(それ以上でも以下でも予後不良)
- 脳血管障害+HT→スライド参照
- 積極的適応なし→ACEI/ARB、チアジド系、CaIから選択する、どの降圧剤でも予後同じ
- 降圧剤の服用タイミングはコンセンサスが得られていないが一般的には血圧は午前高く午後に低下するが夜間に血圧が低下しない人(non-dipper)は死亡リスクが増加するとも言われていた→その後の研究では否定された
→患者の服用アドヒアランスを高める服用方法がよいだろう - 治療抵抗性高血圧(3剤併用でも降圧不十分)→2次性高血圧の精査が必要
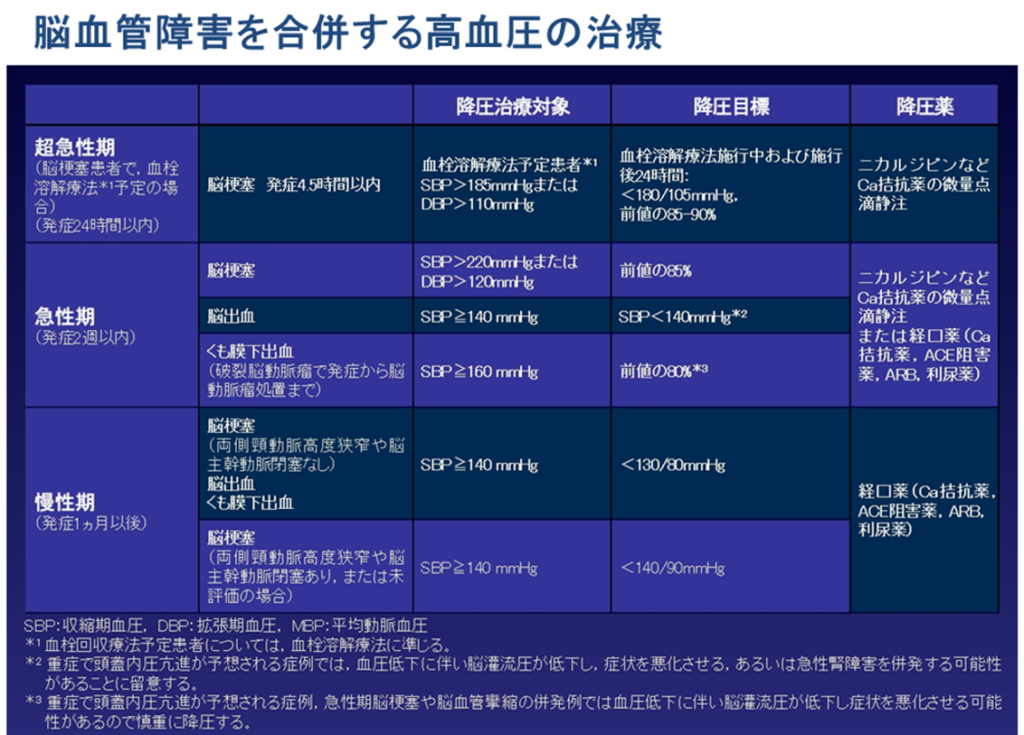
- 一般的には脳血管障害慢性期では Ca 拮抗薬,ACE 阻害薬orARB,利尿薬などが推奨されており,降圧薬の種類よりも降圧そのものが 1 次予防,2 次予防に重要である
標的タンパク質が酵素の場合は阻害薬(inhibitor)、受容体の場合は拮抗薬(antagonist)、イオンチャネルの場合は遮断薬(blocker)等と用語が使い分けられる
治療薬各論
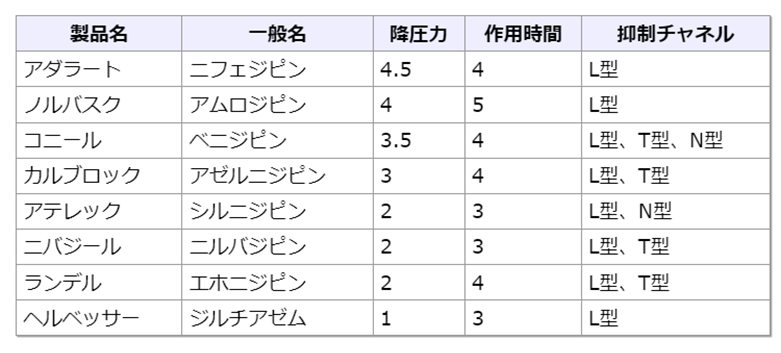
- カルシウム拮抗薬:CCB
Ca拮抗薬は大きく3つの系統(ジヒドロピリジン系、ベンゾチアゼピン系、フェニルアルキルアミン系)に分けられる
ジヒドロピリジン系のCa拮抗薬は血管選択性が高く降圧剤としてのみ用いる
ベンゾチアゼピン系やフェニルアルキルアミン系は心臓(心筋・房室結節)に対する選択性があるので、心抑制作用、心拍低下作用も持ち、主として狭心症、不整脈にも使用される- ジヒドロピリジン系(DHP)
圧受容器反射を介した交感神経の活性化から、反射性の頻脈が起こりやすい
アゼルニジピン(カルブロック、L型/T型)は降圧に伴う心拍数の増加・頻脈が見られにくい
ジヒドロピリジン系は末梢動脈を拡張するため末梢浮腫の有害事象が多い、特に高容量時の出現リスクは2.8倍だがACEIとの併用時は末梢浮腫の発症頻度が少ない→末梢浮腫出現時は減量または変更が必要(チアジド系利尿薬などが費用対効果で優れる、しかもCa拮抗薬による薬剤性浮腫にループ利尿薬は無効)
L型は心筋・血管平滑筋に広く存在し心筋・血管収縮作用を、N型は神経終末に存在し交感神経興奮作用を、T型は主に心臓に存在し洞結節の活動電位発生に関わるため、T型は心保護作用、腎保護作用を、N型は腎保護作用、交感神経抑制効果を併せ持つと言われる。腎微小血管にはL型、N型、T型の3つのチャネルがあり、腎臓においてはL型は輸入細動脈のみを、N型とT型は輸出細動脈も拡張するので、糸球体内圧を下げることができる(腎保護作用)。N型Caチャネルも遮断するシルニジピンは細動脈だけでなく細静脈も拡張させるため、L型Ca拮抗薬に比べ末梢性浮腫をきたしにくいとされる。
CYP3A4で代謝される→薬剤相互作用に注意(アゾール系、マクロライド、シメチジン、グレープフルーツ)- L型:ニフェジピン、アムロジピンなど
CKDの患者には使用しづらい(腎臓の輸入細動脈のみ拡張→糸球体濾過圧上昇)
L型のみに作用するものよりも、N型・T型に作用するもののほうが末梢性浮腫が少ない。
ニフェジピン:作用時間が短く現在はアダラートCRのみ(カプセルやLは販売中止)
アムロジピン:血中半減期が36時間と、他のCCBより圧倒的に長い。
- L型:ニフェジピン、アムロジピンなど
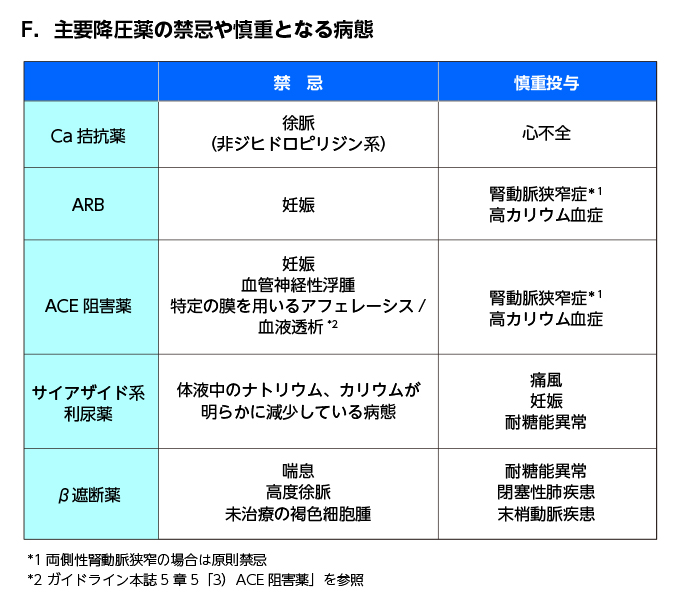
- 非ジヒドロピリジン系:非ジヒドロピリジン系は高度徐脈、心不全には禁忌、ジギタリスやβBとの併用にも注意。
- フェニルアルキルアミン系(PAA):心筋選択性が高い、安静時狭心症には朝の発作を抑えるために、朝と就寝前の2回投与する。
- ワソラン(ベラパミル)・・・心筋のみならず血管のCaチャネルに対して抑制作用をもつので、狭心症や高血圧を合併している不整脈に適している。プラザキサとの併用は注意すること(抗凝固作用増大)。
- ベンゾチアゼピン系(BTZ):DHPとPAAの中間、洞結節や房室結節の活動電位はCaイオン流入で生じるので、上室性不整脈にも有効。
- ヘルベッサー(ジルチアゼム)・・・血管拡張、心筋に対する作用を中等度に持つ。
- フェニルアルキルアミン系(PAA):心筋選択性が高い、安静時狭心症には朝の発作を抑えるために、朝と就寝前の2回投与する。
- ジヒドロピリジン系(DHP)

アダラートカプセル
中身は溶液状→超即効性、そもそも狭心症薬として開発されたため
アダラートL錠
血中濃度の急激な立ち上がりを抑えることにより、また有効な血中濃度を持続させることで、反射性頻脈などの副作用発現の軽減および1日2回の服用による服薬コンプライアンスの向上を目的に開発された。持効化にもっともふさわしい粒度分布を示す粒子の大きさにした微粉化ニフェジピン(micronized nifedipine)を用い、溶出速度を調整することにより持続化を図った。
ニフェジピンの舌下投与は全面的に禁止された→過度な降圧効果、腎不全の悪化、低血圧、急性心筋梗塞、狭心症様発作、脳梗塞、意識消失、死亡等の副作用が報告
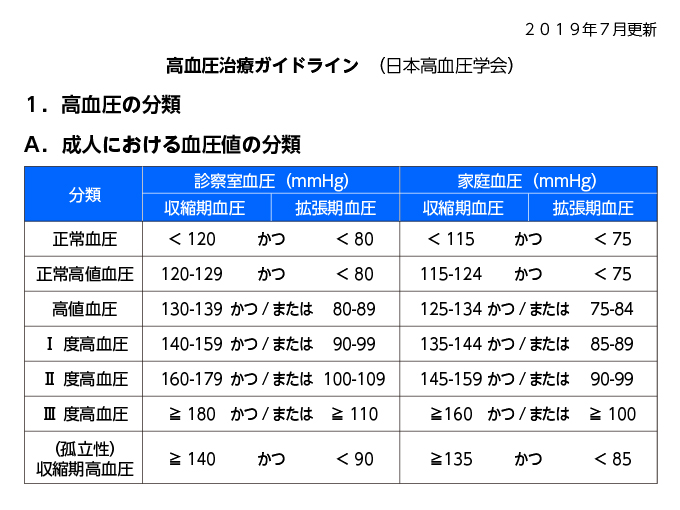
高血圧治療ガイドライン2019
高血圧緊急症→血管拡張薬あるいは交感神経抑制薬の注射薬が推奨
高血圧切迫症(急性あるいは進行性の臓器障害を伴わない高度の高血圧(通常180/120 mmHg以上))に対しては、内服薬による降圧が推奨=アダラートLを使用する(アダラートカプセルは使用しない!!!)
- ARB
- ARBとACEIの併用についてはONTARGET試験にて,「有用性がない一方で,低血圧,腎機能悪化,高Kなどの有害事象が増えた」ため、推奨されない→専門医が併用療法を行うケースはある
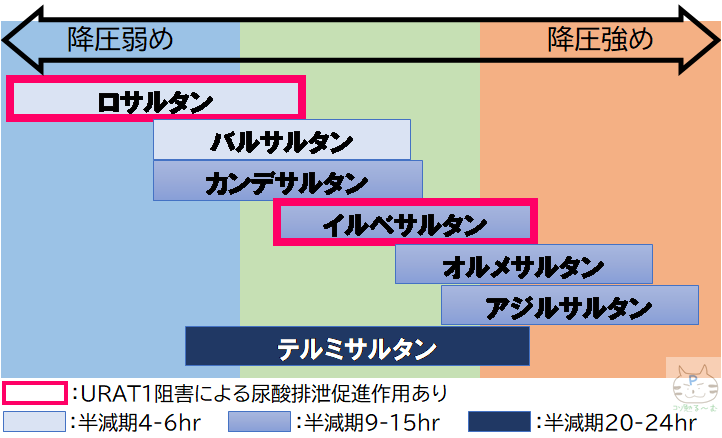
- ロサルタン,イルベサルタンに特有の作用として,尿酸トランスポーターであるURAT1を阻害し,腎からの尿酸排泄を促進する作用がある(尿酸値を上昇させる利尿薬やβ遮断薬との併用が◎)
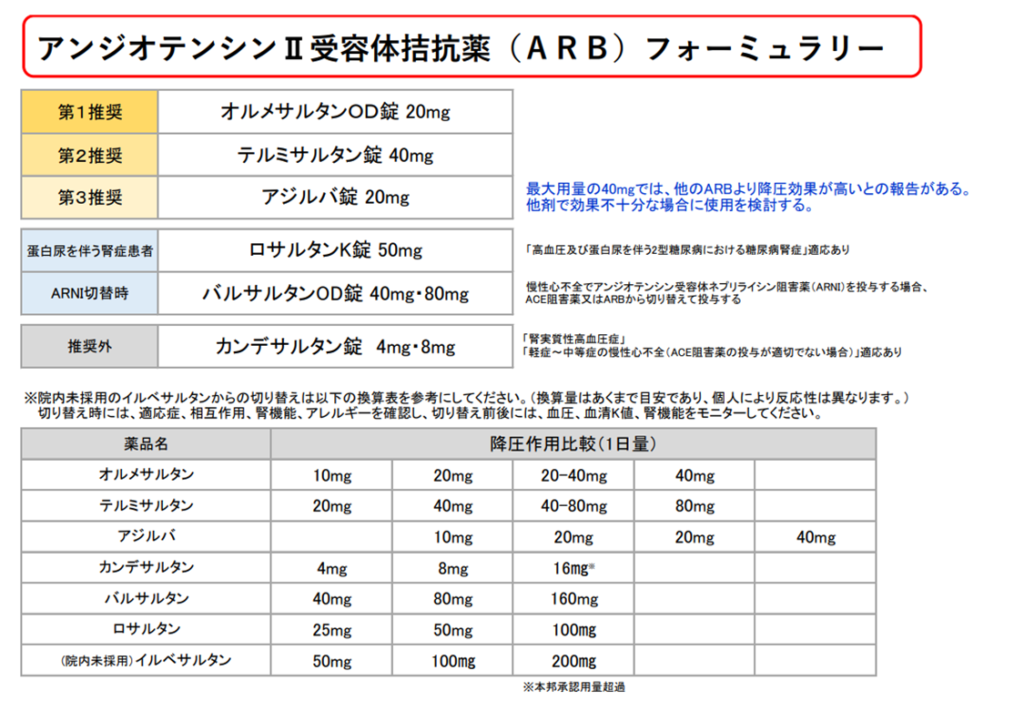
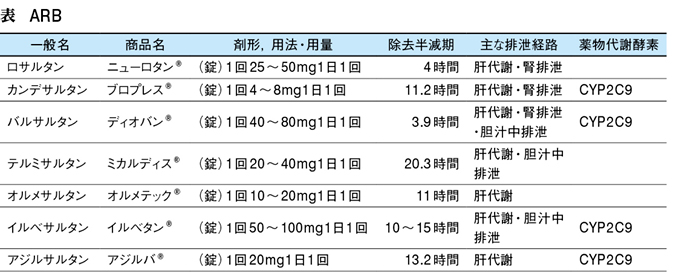
- 各種ARBの特徴
- 血圧を下げたくない(臓器保護目的):ロサルタン(ニューロタン)
- 腎不全・透析:
- イルベサルタン(アバプロ):
→CYP2C9による酸化的代謝とグルクロン酸抱合により代謝 - テルミサルタン(ミカルディス):
→完全肝代謝なので腎機能障害例に好んで使用される。
半減期が24時間と他に比して圧倒的に長い。透析によって除去されない。
- イルベサルタン(アバプロ):
- 血圧を下げたい:アジルサルタン(アジルバ)、オルメサルタン(オルメテック)
- 血圧変動に困っている:テルミサルタンを試してみる
- ACE阻害薬(→心不全治療薬の項目も参照)
- ブラジキニンの増量による空咳が服用者の20~30%にみられる
- 稀に血管神経性浮腫による呼吸困難を生じる。糖尿病治療薬のDPP-4阻害薬との併用で血管神経性浮腫が増加するとの報告がある
- 腎排泄性であり、腎障害時は少量から投与する
- ARB同様、妊婦への投与は禁忌
- 他の副作用は基本的にARBと同様
- ACE阻害薬の種類と特徴→下記3つだけ使用できればよい
- 治療効果はほぼ横並び(アラセプリルとカプトプリルは作用時間短く1日2回内服が必要→めんどい)
- ◎コバシル(ペリンドプリル)
心筋梗塞後のエビデンスが多い.作用時間が長い(1日1回内服ok).欧米と同等量が使用可能で降圧効果大 - ◎◎レニベース(エナラプリル)
心不全の適応症があり,広く使われる(他はリシノプリルだけ) - ◎タナトリル(イミダプリル)
空咳が比較的少ない.欧米と同等量が使用可能で降圧◎
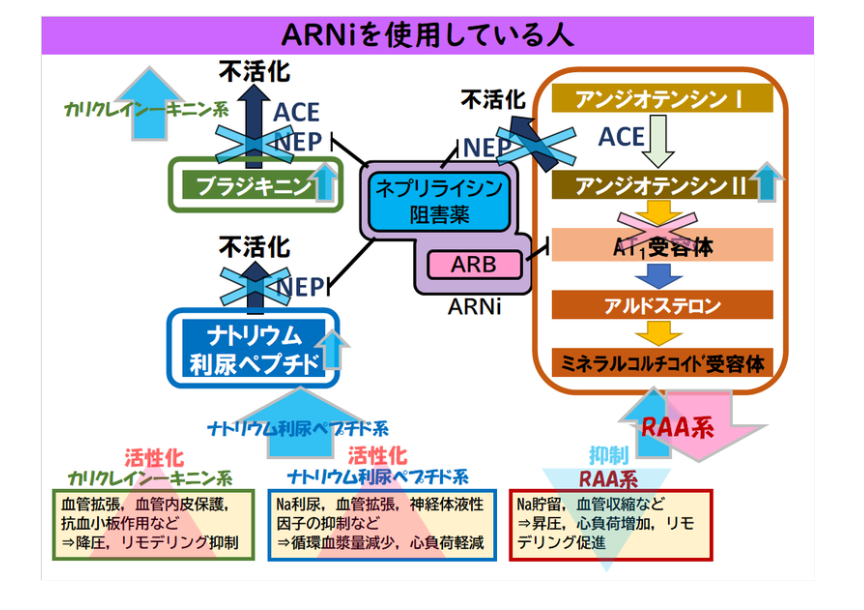
- ARNI(→アンジオテンシン受容体ネプリライシン阻害薬)200㎎=171円→ARB後発品の10倍以上
- 薬剤名サクビトリルバルサルタンで,商品名エンレスト®
- ARNi = ネプリライシン(NEP)阻害薬 + ARB
- サクビトリルバルサルタン200mgにはバルサルタン102.8mg(通常量40~80㎎)相当が含まれる
- 「過度な血圧低下のおそれ等があり、原則として本剤を高血圧治療の第一選択薬としないこと」
- NEP阻害薬はブラジキニンの分解抑制→ACE阻害薬のような空咳や血管浮腫の副作用がありうるが頻度は少ない
- エビデンス
- 心不全:HFrEFに対するエビデンスでACE阻害薬に勝った、ガイドラインでも推奨
- 高血圧:利尿効果があり食塩感受性高血圧やARB抵抗性高血圧に良い適応?ガイドラインには未収載
- α遮断薬:眠前内服が早朝高血圧に有用だが、臓器保護効果は証明されていない
- 降圧剤でありながら心不全リスクが増加する(ALLHAT試験で利尿薬群に比し心不全発症が約 2 倍に増えた)
→高血圧治療ガイドラインの第一選択からも外れ、プライマリケアで使われることはなくなった - 臓器保護効果はなく、心不全患者には禁忌と考えてよい
- A+C+Dの3剤併用療法でも降圧が得られない→治療抵抗性高血圧→βBやαB、MRAを追加する
- 初回投与現象(first dose phenomenon)として起立性低血圧によるめまい、動悸、失神があるが、少量より開始し漸増すれば、他の降圧薬とも併用しやすい
- αBは肥満やメタボリックシンドロームを合併した高血圧に有効
→肥満やメタボリックシンドロームは高インスリン血症や高レプチン血症、交感神経緊張と関係する病態とされ、α1遮断薬はインスリン感受性を改善し脂質代謝を改善する - 家庭血圧測定や24時間血圧測定により診断される早朝高血圧は心血管疾患リスクになるが、α1遮断薬の眠前投与がこれに有効である
- 褐色細胞腫クリーゼには非選択的α遮断薬レギチーン(フェントラミン)の静注と選択的α1遮断薬ドキサゾシンの内服を使用する
- α遮断薬の種類
- ミニプレス(プラゾシン)
- デタントール
- カルデナリン/ドキサゾシン:血管に分布するα受容体に作用し、血管を拡げ、末梢血管抵抗を減少させて血圧を下げる
- 降圧剤でありながら心不全リスクが増加する(ALLHAT試験で利尿薬群に比し心不全発症が約 2 倍に増えた)
- 交感神経中枢抑制薬
- 中枢の交感神経α2受容体を刺激することで血管を拡張させ血圧を下げる薬
- アルドメット
- カタプレス
- メチルドパ
- 中枢の交感神経α2受容体を刺激することで血管を拡張させ血圧を下げる薬
高血圧患者は腎障害を合併する頻度が高く、血圧が高値であるほど腎障害の進行速度が増し、腎障害が強いほど血圧が高くなることは日常診療においてしばしば経験され、血圧と腎機能とは緊密な関係にある。「腎機能」には二つの意味合いがあり、「糸球体濾過量」と「蛋白尿」で、対応するパラメーターはそれぞれ推定糸球体濾過量(eGFR)と微量アルブミン尿になる。CKD合併の高血圧患者に対しては、eGFR保持と微量アルブミン尿を抑えることを目的とした降圧薬選択が重要。血圧が低いほどGFRの低下速度が小さくなることが示されている。CKD合併高血圧の降圧目標は、蛋白尿「無」では140/90mmHg、「有」では130/80mmHg(尿蛋白>1g/日では125/75mmHg未満)。最初に推奨される降圧薬は、ACEI/ARBだが、開始時に腎機能低下(前値からCre値が30%未満の上昇ならそのまま継続投与可)や高K血症が増悪することがあるので注意を要する。血圧と尿蛋白の減少、GFRの保持が管理指標として重要。
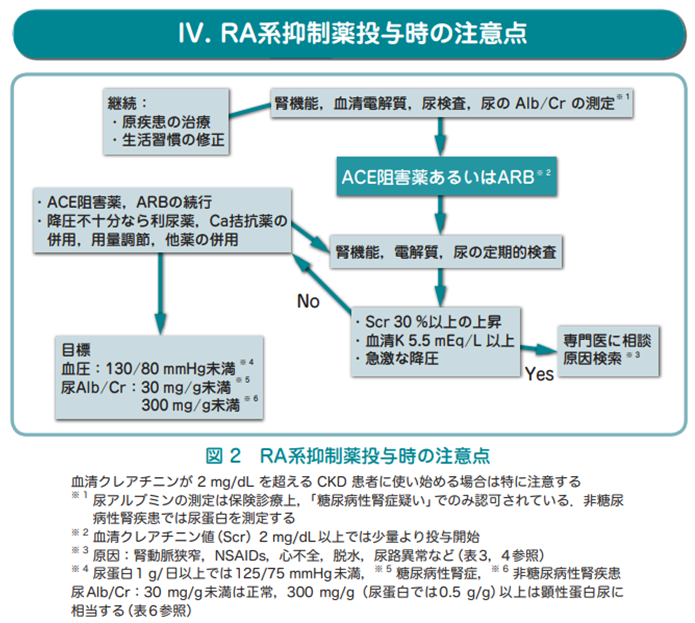
高血圧→腎糸球体保護のため輸入細動脈の収縮→腎血流低下→RAA系のさらなる亢進→血圧上昇→・・・という負のループが続くと、最終的には代償機構が破綻して糸球体内圧が上昇→糸球体硬化→タンパク尿の出現
蛋白尿の出現は,糸球体内圧上昇のマーカー!より厳格な降圧目標設定が必要
さらに蛋白尿→再吸収によるエネルギー不足,サイトカイン産生,尿中補体の活性化などを介して,尿細管間質を障害する
諸悪の根源は高血圧→高血圧を放置することは腎不全→透析覚悟!
腎保護作用の観点からの降圧剤選択
①ACE阻害薬/ARBは,輸出細動脈を拡張→糸球体内圧を下げる→腎疾患の進行を遅らせる
尿蛋白陽性のCKD合併高血圧ではACEI/ARBが第一選択(降圧目標:診察室血圧130/80 家庭血圧125/75)
尿蛋白陰性のCKD合併高血圧では降圧剤優先順位はすべて同等
②
高血圧+糖尿病の場合、尿たんぱく陰性であれば、推奨される降圧剤は特にないが、降圧目標は130/80mmHg未満
糖尿病の有無に関わらず、尿たんぱく陽性(随時尿で>0.15g/gCr)の場合は、ACEI/ARBが推奨され、降圧目標は130/80未満
早朝高血圧→Non-dipper型とモーニングサージ型がある、いずれも心血管イベントのリスクとなるため治療適応、ABPMで両者の鑑別が可能
①Non-dipper型
夜間の血圧低下がない(低下幅が10%未満、正常では夜間血圧は10-20%低下する)
特に,夜間血圧が上昇してしまうケースは riser型と呼ばれる
☆食塩感受性が高いことが言われており,早朝高血圧を見た時は,食塩感受性高血圧の可能性を考え利尿薬= サイアザイドがよい適応となる
②モーニングサージ型高血圧
夜間の血圧は正常にもかかわらず、早朝に急上昇するタイプ
睡眠障害(睡眠時無呼吸症候群),加齢,耐糖能異常,飲酒,喫煙,精神的・肉体的ストレスが原因とされる
- 早朝高血圧の治療方針
- 血圧変動の問題なので,長時間作用型の降圧薬を使用するのが原則
- 睡眠障害(睡眠時無呼吸症候群)の治療
- 減量
- 就寝前にβ遮断薬やα遮断薬,ACE阻害薬/ARBを内服
- ARNiであるエンレストは,国内第三相臨床試験において,24時間平均血圧を対照薬のオルメサルタンに比して有意に低下させたので、早朝高血圧にも有用である可能性が高い
サイアザイド系利尿薬は、遠位尿細管においてNa+とCl–の再吸収を抑制することで降圧効果をもたらす。
サイアザイド系利尿薬は、1~2時間で利尿作用を発揮し、作用は約16~24時間持続。
サイアザイド系利尿薬の欠点としては、用量増加による累積効果が期待できず、腎機能障害では効果が発揮されにくい。
ラシックスの作用時間は4~5時間と短く、持続的な利尿作用を期待する場合は、複数回の投薬が必要でNaの尿中への喪失は投薬後早期に出現するが、作用持続時間が短いために、Naの総喪失量はサイアザイドよりもむしろ軽度にとどまる。
降圧薬としての利便性を考慮した場合、1日1回の服薬で持続的な降圧効果を発揮し、QOLを阻害する頻回の排尿現象をできるだけ抑えるために、少量サイアザイド系利尿薬の使用がラシックスより優れている
SAS
- 中等症以上の睡眠時無呼吸症候群(SAS)の患者数が潜在的なものを含めると900万人
- 睡眠時無呼吸症候群の半数は40〜50代の男性だが、女性でも閉経後に発症する人が増加
- 睡眠時無呼吸症候群が心疾患の突然死を引き起こす危険度は2.57倍高い
- 重症の睡眠時無呼吸症候群を持つ人が交通事故を起こす確率は、健康な人に比べて2.5倍も高い
- 睡眠時無呼吸症候群の重症度は、睡眠1時間辺りの無呼吸と低呼吸の合計回数(AHI)を調べることで判定する
- 軽症 5~15回
中等症 15~30回未満
重症 30回以上 重症SASの8年生存率63%
- 軽症 5~15回
- 酸素濃度が下がる→高血圧、動脈硬化の進展→心筋梗塞や脳梗塞を起こしやすくなる
- 睡眠不足によるストレスにより、血糖値やコレステロール値が高くなり、さまざまな生活習慣病やメタボリック・シンドロームがひきおこされる
- 1時間あたり10秒以上の呼吸停止が20回以上出現するような中等症・重症の睡眠時無呼吸症候群を放置すると、心筋梗塞・脳梗塞・生活習慣病・眠気による事故などを引き起こし、死亡率が非常に高くなるため、すぐに治療が必要
- ひどいイビキ、睡眠中の呼吸停止がある場合には速やかに専門の医療機関で検査・治療を受けることが重要